题目内容
【题目】咱们学校化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
(1)①本实验中,测量O2体积的装置是(选填下图1中的装置编号). 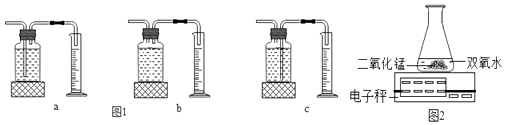
②实验结论:在相同条件下, , 双氧水分解速率越快.
③B小组用如图2装置进行实验,该变化的文字或符号表达式为 , 通过比较也能达到实验目的.
(2)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂.于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验: 
(I)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
, 带火星的木条复燃; | ; | 将固体加入盛有5mL5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象. | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂. |
(II)步骤①的目的是 .
(III)步骤⑦是证明 .
(3)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积;②测 .
(4)计算:12.25g KClO3中所含氧元素质量与克过氧化氢中所含氧元素的质量相等?
【答案】
(1)c;过氧化氢浓度越高;过氧化氢 ![]() 水+氧气或2H2O2
水+氧气或2H2O2 ![]() 2H2O+O2↑;单位时间内电子天平的质量示数减少的多少
2H2O+O2↑;单位时间内电子天平的质量示数减少的多少
(2)有大量气泡产生;固体质量仍为0.2g;与步骤③对比,检验加入氧化铜前后过氧化氢溶液的分解速率有无变化;氧化铜的化学性质在反应前后没有改变
(3)收集相同体积O2所需的时间
(4)解:设所需过氧化氢的质量为x,则x× ![]() ×100%=12.25g×
×100%=12.25g× ![]() ×100%,x=5.1g.故填:5.1
×100%,x=5.1g.故填:5.1
【解析】解:①图1装置中的c装置中,氧气通过左边导管进入瓶中,由于氧气不易溶于水,把水压入量筒中,量筒中收集的水的体积即为反应生成氧气的体积,因此本实验中,应选用图1装置中的c来测量氧气的体积.
故填:c.②分析该实验数据可得:在双氧水和二氧化锰的质量相同的情况下,双氧水浓度越高,相同时间内产生氧气的体积越多,即在相同条件下,双氧水浓度越高,分解得越快.
故填:过氧化氢浓度越高.③双氧水在二氧化锰的催化作用下生成水和氧气,反应的文字表达式过氧化氢 ![]() 水+氧气,反应的化学方程式为:2H2O2
水+氧气,反应的化学方程式为:2H2O2 ![]() 2H2O+O2↑;乙同学用图2装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢,即单位时间内电子天平的质量示数减少的越快,氧气产生的越多,双氧水分解的越快;故填:过氧化氢
2H2O+O2↑;乙同学用图2装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢,即单位时间内电子天平的质量示数减少的越快,氧气产生的越多,双氧水分解的越快;故填:过氧化氢 ![]() 水+氧气或2H2O2
水+氧气或2H2O2 ![]() 2H2O+O2↑;单位时间内电子天平的质量示数减少的多少;(2)(I)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故步骤③中的现象是有气泡产生,带火星的木条复燃;催化剂的特点是“一变,二不变”,反应前后其质量不变,所以步骤⑥中称量的氧化铜的质量仍为0.2g;故填:有大量气泡产生; 固体质量仍为0.2g;(II)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论;故填:与步骤③对比,检验加入氧化铜前后过氧化氢溶液的分解速率有无变化;(III)步骤⑦证明氧化铜的性质在反应前后没有发生改变,在实验中起到的是催化剂的作用;故填:氧化铜的化学性质在反应前后没有改变;(3)在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间;所以答案是:收集相同体积O2所需的时间;
2H2O+O2↑;单位时间内电子天平的质量示数减少的多少;(2)(I)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故步骤③中的现象是有气泡产生,带火星的木条复燃;催化剂的特点是“一变,二不变”,反应前后其质量不变,所以步骤⑥中称量的氧化铜的质量仍为0.2g;故填:有大量气泡产生; 固体质量仍为0.2g;(II)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论;故填:与步骤③对比,检验加入氧化铜前后过氧化氢溶液的分解速率有无变化;(III)步骤⑦证明氧化铜的性质在反应前后没有发生改变,在实验中起到的是催化剂的作用;故填:氧化铜的化学性质在反应前后没有改变;(3)在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间;所以答案是:收集相同体积O2所需的时间;
【考点精析】掌握催化剂的特点与催化作用和书写化学方程式、文字表达式、电离方程式是解答本题的根本,需要知道催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用;注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案