题目内容
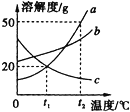
【题目】根据KNO3和NaCl的溶解度曲线,回答下列问题:
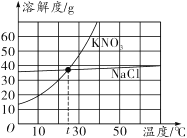
(1)10℃时,KNO3的溶解度为________g。
(2)有一杯接近饱和的硝酸钾溶液,要使其达到饱和的方法是____________(写一种)。
(3)在t℃时,将a g KNO3、b g NaCl分别溶解在50ml水中恰好饱和,则a______b(填“>”、“<”或“=”)。
【答案】20降温(或增加溶质或蒸发溶剂)=
【解析】
(1)通过分析溶解度曲线可知,在10℃时KNO3的溶解度是20g;
(2)硝酸钾的溶解度随温度的升高而增大,将其不饱和溶液变成饱和溶液,可降温(加溶质、蒸发溶剂);
(3)在t℃时,将ag硝酸钾、bg氯化钠分别溶解在50mL水中恰好饱和,说明在该温度下,这两种物质的溶解度相等,溶解的溶质也相等,即a=b。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究.
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 蓝紫色 | 蓝色 | 绿色 | 黄色 |
查阅资料:
pH | 7.5~9 | 10~11.9 | 12~14 |
紫甘蓝汁液显示的颜色 | 蓝色 | 绿色 | 黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为_____.
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由_____色变为_____色.向其中加入稀盐酸,该反应的化学方程式为_____.
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示.
【得出结论2】从微观角度分析,该反应的实质是__________.
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得列pH变化与时间的关系如图2、图3所示.
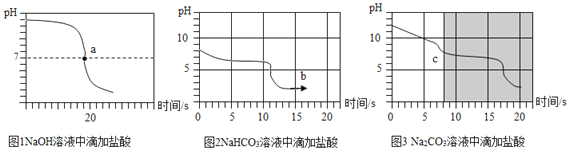
【交流与反思】b点的溶质为_____(写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质_____(写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_____________、____________.
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程.