题目内容
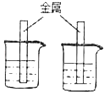
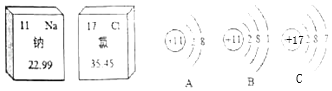
【题目】为验证铜、铁、锌三种金属的活动性顺序,甲同学与乙同学分别设计了不同的实验方案,都能达到实验目的。实验室可供选择的试剂有:锌片、铁片、铜片、硫酸锌溶液(无色)、硫酸亚铁溶液(浅绿色)、硫酸铜溶液(蓝色),实验方案如表:
实验方案 | 方案一 | 方案二 |
实验操作 |
一种金属放入两种溶液中 |
两种金属同时放入一种溶液中 |
(1)方案一选择的金属_____;
(2)方案二中,当金属足量时,最终烧杯中液体呈_____色;
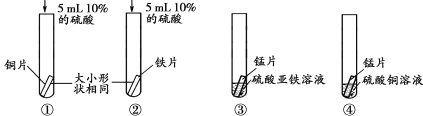
(3)其他同学设计了以下不同实验方案,其中同样可以达到实验目的有_____(填字母)
A.取一定量硫酸锌溶液,分别加入铁片与铜片
B.取一定量硫酸铜溶液,加入足量铁片充分反应后取出铁片,再加入锌片
C.取一定量硫酸亚铁溶液,加入锌片,一段时间后把锌片表面新得物质加入一定量硫酸铜溶液中
【答案】铁 无 BC
【解析】
活动性强的金属能够将活动性弱的金属从其盐溶液中置换出来,反之也可以通过金属是否与另一种金属的盐溶液反应判断两种金属的活动性。
(1)比较三种金属活动性顺序,需要相邻两种金属相互比较,选择铁片分别加入到硫酸锌和硫酸铜溶液中,通过是否反应验证金属活动性:Fe<Zn,Fe>Cu,故方案一选择的金属是:铁;
(2)两种金属放入一种溶液中,一种金属发生反应,另一种金属不反应,能够顺利比较三种金属活动性顺序,选择两种金属为锌片和铜片,溶液为硫酸亚铁,其中只有锌与硫酸亚铁能发生化学反应,当锌片足量时,最终溶液中只含有水和硫酸锌,溶液为无色;
(3)A、铁片和铜片都不与硫酸锌溶液反应,只能证明铁、铜的活动性都比锌弱,但铁和铜的活动性不能比较,故A不正确;
B、硫酸铜溶液与足量铁片反应,证明金属活动性:Fe>Cu,反应结束后溶液由蓝色硫酸铜溶液变成硫酸亚铁溶液,再加入锌片,锌置换出金属铁,证明金属活动性:Zn>Fe,所以B正确;
C、锌片与硫酸亚铁反应表面生成单质铁,证明金属活动性:Zn>Fe,取锌片表面铁单质与硫酸铜反应,得到红色铜,证明金属活动性:Fe>Cu,所以C正确。故选BC。

【题目】实验室用如图装置进行碳酸钠的性质实验,烧杯A中是澄清石灰水并滴加了酚酞,C中是石灰乳.实验开始前,称取10.6g纯碱置于B中,关闭开关K1打开K2,并加入一定量的稀硫酸.
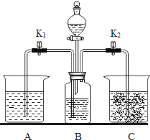
①烧杯C中并没有明显现象,为了证明B中的确产生了CO2,现将C中液体进行固液分离,该分离操作除烧杯外,还需用到的玻璃仪器有_____ (写名称).过滤后滤液能使酚酞试液变红,则滤液中的主要溶质是_____,该现象_________ (填写“能”或“不能”)说明产生了CO2.
②上述过滤后的滤渣可能存在Ca(OH)2和CaCO3.某同学为证明该两种物质同时存在,在一支试管中取少量样品,经过两个步骤完成了检验.若所有检验实验均在该支试管中进行,请完成实验报告:
实验步骤 | 所用的试剂或检验方法 | 结 论 |
步骤一 | _________ | 证明______存在 |
步骤二 | _________ | 证明_______存在 |
③实验一段时间后,关闭开关K2打开K1,见到B中液体将会压入到烧杯A中,实验中可能见到不同的现象,请完成下表:
预测的反应现象 | B中反应后,溶液中溶质的化学式 | 烧杯A中发生的主要反应的化学方程式 |
A中溶液产生大量的白色沉淀产生,红色不褪去. | _________ | _______________ |
A中溶液并没有大量的白色沉淀产生,红色褪去. | _____________ | ________________ |
【题目】市场上的加碘食盐通常加入的是碘酸钾(KIO3),替代了原来的碘化(KI),因为碘化钾容易被氧气氧化。为探究不同条件下KI与O2的反应,进行如下系列实验。
(查阅资料)①碘单质(I2)遇淀粉液变蓝。②部分酸、碱、盐通常在水溶液中以离子形式存在,如:盐酸中存在H+和Cl-。
(进行实验)
实验1 将不同浓度的KI溶液置于纯氧中,放置相同时间后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ①2 mL 0.15%KI溶液+5滴淀粉液 | 无明显变化 |
②2 mL 1.5%KI溶液+5滴淀粉液 | 溶液变蓝 | |
③2 mL 15%KI溶液+5滴淀粉液 | 溶液变蓝,颜色较②深 |
实验2 将相同浓度的KI溶液加入不同浓度的稀盐酸后置于纯氧中,5分钟后观察,现象如下表:
装置 | 烧杯中的液体 | 现象 |
| ④ 2 mL 15%KI溶液+5滴淀粉液+2mL蒸馏水 | 无明显变化 |
⑤ 2 mL 15%KI溶液+5滴淀粉液+2 mL1% 盐酸 | 溶液变蓝 | |
⑥ 2 mL 15%KI溶液+5滴淀粉液+2 mL 10% 盐酸 | 溶液变蓝,颜色较⑤深 |
(解释与结论)
(1)实验1的目的是___________________________。
(2)实验2中通过对比⑤和⑥,得出的结论是______________________。
(3)实验2中,KI在盐酸的作用下与O2反应的化学方程式如下,补全该反应的化学方程式:4KI+O2+4HCl=4KCl+2______+________。
(反思与评价)
(4)实验④中加2mL蒸馏水的作用是_____________________。
(5)某同学将实验⑥中2 mL10% 盐酸替换成2 mL10% NaCl溶液,5分钟后溶液颜色无明显变化,从离子角度分析,由此得出的结论是_________________________________。