题目内容
【题目】化学是以实验为基础的学科,根据下列实验回答问题。
实验一 | 实验二 | 实验三 |
|
|
|
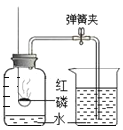
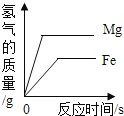
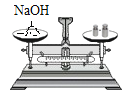
(1)实验一:待红磷熄灭冷却后,打开弹簧夹,观察到集气瓶内水面上升约______。该实验现象说明氮气具有的性质是不可燃、不助燃以及____。
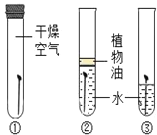
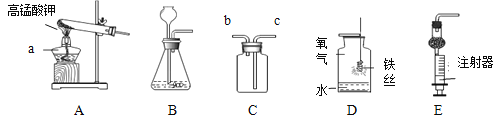
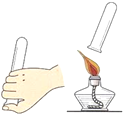
(2)实验二:三天后,观察到序号为____的试管中的铁钉明显生锈。对照实验②和③,可知铁锈蚀与____有关。
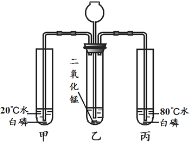
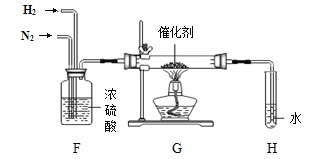
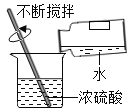
(3)实验三:从长颈漏斗注入过氧化氢溶液,乙中发生反应的化学方程式为______。白磷的着火点为40 ℃。甲、丙中不同的现象是____。
【答案】![]() 不易溶于水(或难溶于水) ③ 氧气 2H2O2
不易溶于水(或难溶于水) ③ 氧气 2H2O2 ![]() 2H2O+O2↑ 甲中白磷不燃烧,丙中白磷燃烧
2H2O+O2↑ 甲中白磷不燃烧,丙中白磷燃烧
【解析】
(1)红磷燃烧生成五氧化二磷固体,待红磷熄灭并冷却后,打开弹簧夹,观察到烧杯中的水进入集气瓶,瓶内水面最终上升约1/5,由此可知氧气约占空气总体积的五分之一;红磷熄灭后,集气瓶内剩下的气体主要是氮气,氮气难溶于水、不支持燃烧。故填:![]() ;难溶于水;
;难溶于水;
(2)试管③中的铁钉同时与空气和水接触,最先生锈,对照实验②和③,可知铁锈蚀与氧气有关。
故填:③;氧气;
(3)乙中过氧化氢在二氧化锰作催化剂下分解生成氧气和水,反应的化学方程式为2H2O2 ![]() 2H2O+O2↑;甲、丙中不同的现象是甲中白磷不燃烧,丙中白磷燃烧。
2H2O+O2↑;甲、丙中不同的现象是甲中白磷不燃烧,丙中白磷燃烧。
故填:2H2O2 ![]() 2H2O+O2↑;甲中白磷不燃烧,丙中白磷燃烧。
2H2O+O2↑;甲中白磷不燃烧,丙中白磷燃烧。

【题目】某实验小组同学对铁粉和氧化铜的混合物与足量的稀硫酸混合后,体系中各反应的先后顺序进行研究。
氧化铜与稀硫酸反应的化学方程式为________________。
(进行实验)以下实验中所用硫酸都是过量的。
实验1:将铁粉和氧化铜的混合物与60mL、10%稀硫酸混合,实验记录如下。
序号 | 铁粉/g | 氧化铜/g | 实验现象 |
1-1 | 0.56 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈蓝色 |
1-2 | 1.12 | 1.6 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
1-3 | 1.68 | 1.6 | 立即出现红色固体,待红色固体不再增加后产生大量气泡,充分反应后溶液呈浅绿色 |
实验2:将1.12g铁粉和1.6g氧化铜的混合物与30mL不同浓度的硫酸混合,实验记录如下。
序号 | 硫酸浓度/% | 实验现象 |
2-1 | 20 | 立即出现红色固体,无气泡产生,充分反应后溶液呈浅绿色 |
2-2 | 30 | 立即出现红色固体,瞬间产生大量气泡,充分反应后溶液呈浅蓝色 |
2-3 | 50 | 立即出现红色固体,瞬间产生大量气泡,反应过程中生成红色固体的同时持续产生细小气泡,充分反应后溶液呈浅蓝色 |
(解释与结论)
(1)浅绿色溶液中一定含有的溶质是H2SO4、____。
(2)实验中出现红色固体反应的化学方程式为_________;
(3)依据实验1推测,在稀硫酸浓度为10%,且硫酸足量的条件下,铁粉、氧化铜与稀硫酸反应的先后顺序为________。
(4)对比分析实验1-2与1-3,解释实验1-2没有产生气泡的原因______。
(5)在实验1-3中,产生氢气的质量最多为____ g。
6)根据实验2判断,下列说法不正确的是____(填字母序号)。
A 硫酸浓度为20%,CuO先于Fe与硫酸反应
B 硫酸浓度为40%,Fe将先于CuO与硫酸反应
C 硫酸浓度为50%,Fe与CuSO4反应的同时也与硫酸反应