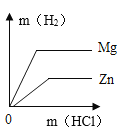
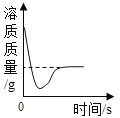
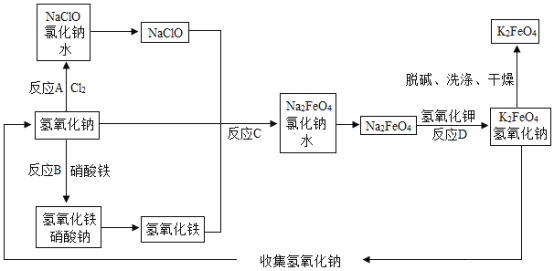
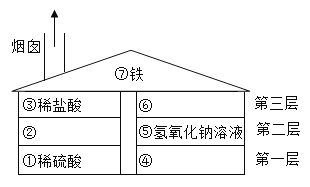
题目内容
【题目】某化学反应的微观过程如下图(其中“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表氮原子,“
”代表氮原子,“![]() ”代表氧原子),下列叙述中,正确的是
”代表氧原子),下列叙述中,正确的是
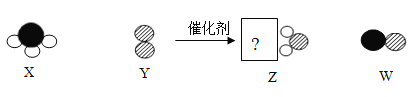
A.该反应类型为置换反应
B.该反应中氧元素的化合价发生了变化
C.所得生成物Z和W的质量比为9:15
D.该反应中原子、分子种类都未发生变化
【答案】B
【解析】
据图可知,反应前X物质是NH3,Y是O2,反应后Z是H2O,W是NO,则其化学方程式为4NH3+5O2 6H2O+4NO,则:
6H2O+4NO,则:
A、置换反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应。因为生成物为两种化合物,故不可能为置换反应,故A错误;
B、因为反应物氧气中氧元素的化合价为0,而H2O和NO中的氧元素的化合价为-2,故该反应中氧元素的化合价发生了变化,故B正确;
C、根据反应的化学方程式,所得生成物Z和W的质量比为(6×18):(4×30)=9:10,故C错误;
D、该反应中分子种类都发生变化,而原子的种类未发生变化,故D错误。
故选:B。

 华东师大版一课一练系列答案
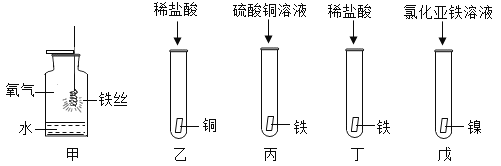
华东师大版一课一练系列答案【题目】“五一”假期,聪聪同学和家入到故宫去参观,发现故宫内许多铜制品表面有一层绿色物质。绿色物质是什么?它是怎样形成的?化学活动课上,同学们设计实验对这种绿色物质进行了如下探究活动。
[查阅资料]
①铜在空气易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的硫酸铜粉末遇水能变为蓝色。
探究活动一:验证铜锈的组成。
[进行实验1]
同学们设计了如图所示装置并进行实验。
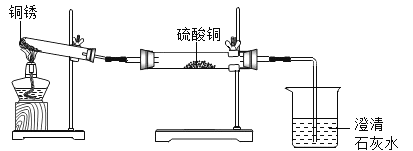
实验操作 | 实验现象 | 实验结论 |
①按上图组装仪器,装入药品。 ②加热铜锈,直至不再有气体产生。 | 绿色固体变为黑色,硫酸铜粉末变为蓝色,烧杯中液体变浑浊 | 加热铜锈生成的物质有CuO、_____,烧杯中发生反应的化学方程式为___________ |
③冷却后,向试管中黑色固体加入适量稀硫酸。 | 黑色固体溶解,溶液变为蓝色 |
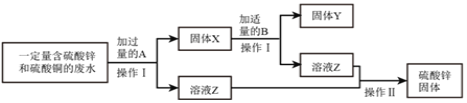
探究活动二:探究铜生锈的条件。
[进行实验2]
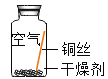
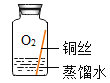
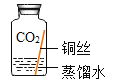
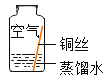
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
序号 | 实验内容 | 实验现象与结论 |
实验1 |
| 在干燥环境中,铜不生锈 |
实验2 |
| 铜仅与氧气和水接触,不生锈 |
实验3 |
| 铜仅与二氧化碳和水接触,不生锈 |
实验4 |
| 铜生锈,它生锈的条件是___________________ |
/span>
[反思与拓展]
(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其目的是__________________。
(2)如果要除去铜制品表面的铜锈,可以用稀盐酸浸泡,写出反应的化学方程式___________________。