题目内容
【题目】金属是一种重要的资源。
(1)为减少污染并变废为宝,某化学小组实验探究工业废水的综合利用,设计了以下流程 图并完成了回收金属铜和硫酸锌的实验。
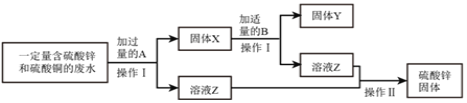
①固体 X 的成分是______;操作Ⅰ需用的玻璃仪器有烧杯、玻璃棒和______。
②上述流程中,在加入适量 B 时反应的化学方程式为______。
③操作Ⅱ中玻璃棒的作用是______。
(2)某同学为探究 Mg、Fe、Cu 三种金属的有关性质,进行了 如图甲所示的实验,实验后把两试管中的物质倒入烧杯中(如 图乙),
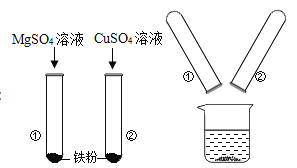
甲 乙
发现烧杯内的红色固体明显增多,充分反应后过滤,滤 液中含有的金属离子的可能组合有______(填字母)。
AMg2+ BMg2+和 Fe2+ CMg2+和 Fe3+ DMg2+和 Cu2+ EMg2+、Fe2+和 Cu2+
【答案】铜、锌 漏斗 Zn+H2SO4=ZnSO4+H2↑ 搅拌使液体均匀受热,防止液体飞溅 BE
【解析】
(1)①锌和硫酸铜反应生成硫酸锌和铜,所以加入的A是锌,所以X的成分为锌、铜,操作Ⅰ分离出了固体和溶液,所以操作I是过滤,需用的玻璃仪器有烧杯、玻璃棒和漏斗;
②由于固体X中含有过量的锌,要得到硫酸锌应除去,应加入稀硫酸,据此写出反应的花絮方程式;
③根据蒸发时分析玻璃棒的应用。
(2)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,与酸反应生成氢气的速率越大,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此分析判断。
(1)①锌和硫酸铜反应生成硫酸锌和铜,所以加入的A是锌,所以X的成分为锌、铜,操作Ⅰ分离出了固体和溶液,所以操作I是过滤,需用的玻璃仪器有烧杯、玻璃棒和漏斗;
②由于固体X中含有过量的锌,要得到硫酸锌应除去锌,应加入稀硫酸,所以在加入适量B时反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑。
③操作Ⅱ是蒸发,玻璃棒的作用是搅拌使液体均匀受热,防止液体飞溅。
(2)由于镁的活动性大于铁,铁不能与硫酸镁反应;铁的活动性大于铜,铁能将铜从其溶液中置换出来,由题意可知,实验后把两试管中的物质倒人烧杯中(如图乙)发现烧杯内的红色固体明显增多,说明了乙中的铁完全反应了,甲中的铁又与硫酸铜发生了反应。若硫酸铜完全反应了,溶液中的阳离子是:Mg2+和Fe2+;若硫酸铜没有完全反应,溶液中的阳离子是:Mg2+、Fe2+和Cu2+.由以上分析可知,BE正确。
故答为:(1)①铜、锌,漏斗;②Zn+H2SO4═ZnSO4+H2↑;③搅拌使液体均匀受热,防止液体飞溅。(2)BE。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案