题目内容
【题目】在丰富多彩的物质世界里,碳及其化合物占有重要地位。
(1)金刚石和石墨均是碳元素组成的单质,但两者物理性质差异较大,其原因是构成它们的碳原子_____不同。
(2)活性炭有较强的吸附能力,是因为活性炭具有_____的结构。
(3)在书写具有保存价值的图书档案时,规定使用碳素墨水,其原因是_____。
(4)某有机化合物R在氧气中充分燃烧的化学方程式是2R+5O2![]() 4CO2+2H2O,则R的化学式为_____。
4CO2+2H2O,则R的化学式为_____。
【答案】排列方式 疏松多孔 碳在常温下化学性质不活泼 C2H2
【解析】
(1)金刚石和石墨物理性质差异较大,是因为构成它们的碳原子排列方式不同。 故填:排列方式
(2)活性炭有较强的吸附能力,是因为活性炭具有疏松多孔的结构。故填:疏松多孔
(3)在书写具有保存价值的图书档案时,应使用碳素墨水笔,是因为碳素墨水中含有炭黑,炭黑的主要成分是碳,碳在常温下化学性质不活泼。 故填:碳在常温下化学性质不活泼
(4)由质量守恒定律:反应前后,原子种类、数目均不变,则2R分子中含有4个碳原子和4个氢原子,则每个R分子由2个碳原子和2个氢原子构成,则物质X的化学式为C2H2。 故填:C2H2

【题目】填写化学用语
地壳中含量最多的金属元素 | 两个氯原子 | 三个钠离子 | 画铝原子的结构示意图 |
_____ | _____ | _____ | _____ |
木炭燃烧的文字表达式_____ | 产生刺激性气味气体反应的符号表达式_____ | ||
2Mg2+中前面的“2”表示_____,右上角的“2”表示_____ | |||
若“ | |||
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式_______________。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:__________________。
(3)小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。

(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象及结论 |
_________ | _________ |
(反思与交流):空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:____________。
【题目】氢氧化钾是一种常见的碱.某化学兴趣小组的同学依据绿色化学的核心及原则,利用所学的化学知识,设计了制备氢氧化钾的方案,同时还可制得纯碱等物质,具体流程如图所示(部分反应、条件和产物已经略去):
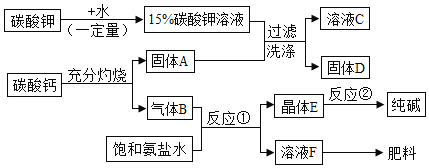
(提出问题1)溶液C中的溶质除氢氧化钾外,还含有什么?
(猜想与假设1)猜想1:K2CO3 猜想2:Ca(OH)2
(实验与探究1)小林同学设计了如下实验对猜想进行探究
实验操作 | 实验现象 | 实验结论 |
取少量溶液C于试管中,滴加稀盐酸 | _____ | 猜想1错误 |
同学们经过讨论分析后认为小林的实验结论不严密,理由是_____.
(提出问题2)固体D中的成分是什么?
(猜想与假设2)小军同学经分析认为一定含有CaCO3,原因是_____(用化学方程式表示);可能还含有_____.
(实验与探究2)请你设计一个简单可行的实验方案,证明固体D中存在猜想与假设2中可能还含有的物质_____(所用试剂只能为溶液).
(表达与交流)由反应①和反应②原理制备纯碱的方法就是我国著名的“侯氏制碱法”,请写出反应①的化学方程式_____.
(反思与评价)请你写出以上物质制备流程方案中体现绿色化学的核心及原则的一点_____.
【题目】新能源的开发和利用是人类社会可持续发展的重要课题。氢、氧燃料电池是一种新型能源,所用的氧气从空气中获得的方法是______。空气中的氧气按体积计算,大约是空气总体积的![]() 。氢气可用天然气制取,这种方法制取的氢气中往往混有二氧化碳和一氧化碳,为了证明混合气体中H2、CO2、CO三种气体都存在,一化学实验小组设计以下实验。
。氢气可用天然气制取,这种方法制取的氢气中往往混有二氧化碳和一氧化碳,为了证明混合气体中H2、CO2、CO三种气体都存在,一化学实验小组设计以下实验。
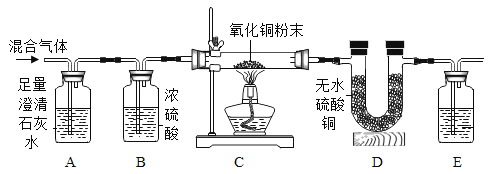
(阅读提示)
①实验前,装置内的空气已排尽。
②实验过程中的尾气已处理。
③无水硫酸铜是白色粉末,吸水后变蓝。
请回答下列问题。
(1)A装置的作用是______。
(2)C装置中的实验现象是______。
(3)E装置中盛放的试剂应该是______,该装置中发生反应的化学方程式为______。
(4)证明氢气存在的实验现象是______。
(5)另一小组同学利用上述实验装置(把其中的E装置换成装有碱石灰的干燥管),仿照上述实验过程,通过定量的方法确定一氧化碳存在,记录实验数据如下:
(注:反应生成的水蒸气被D装置完全吸收,不考虑其他水蒸气对实验结果的影响)
实验前C装置玻璃管内固体总质量/g | m1 |
实验后C装置玻璃管内固体总质量/g | m2 |
实验前D装置总质量/g | n1 |
实验后D装置总质量/g | n2 |
利用如表数据,计算出能证明CO存在的质量关系是______。(用m1、m2、n1、n2表示)
【题目】(1)水与人类的生活密切相关。
①硬水给生活和生产带来许多麻烦,一般可用_____来区分硬水和软水。
②可利用活性炭吸附水中的异味和色素,活性炭的吸附性属于_____(填“物理”或“化学”)性质。
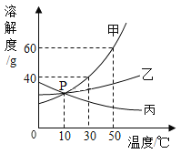
(2)下表是KNO3和Ca(OH)2在不同温度时的溶解度。回答有关问题:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
Ca(OH)2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | |
①两种物质中,溶解度随温度升高而减小的是_____。
②60℃时,按图示操作:
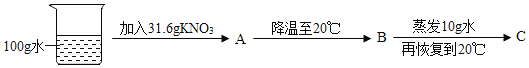
A中的溶液是_____(填“饱和”或“不饱和”)溶液。
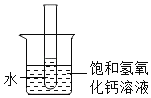
C中析出固体的质量是_____g。
③如图,向烧杯中加入一定量的硝酸铵固体,此时试管中氢氧化钙溶液的溶质质量分数将_____(填“变大”不变”或“变小”)。