题目内容
【题目】如图是某浓盐酸试剂瓶上标签的部分内容. 
(1)将浓盐酸敞口放置,其质量分数会变小,这是由于浓盐酸具有较强的 , 所以浓盐酸必须密封保存;
(2)将该瓶浓盐酸全部配制成溶质质量分数为11.8%(密度约为1.06g/mL)的盐酸,需加入水mL(ρ水=1g/mL);
(3)含杂质40%的石灰石100g与足量稀盐酸充分反应,理论上可得到CO2多少克?(假设杂质不与稀盐酸反应)
【答案】
(1)挥发性
(2)1210
(3)解:根据碳酸钙与盐酸反应的化学方程式,已知碳酸钙的质量可求出二氧化碳的质量
设可得到二氧化碳的质量为x
CaCO3+2HCl═CaCl2+H2O+ | CO2↑ |
100 | 44 |
100g×(1﹣40%) | x |
![]() =
= ![]() x=26.4g
x=26.4g
【解析】解:(1)浓盐酸具有挥发性,能挥发出氯化氢气体,使溶质质量分数变小,故应密封保存.(2)根据加水稀释前后溶质质量不变,设需加水的体积为x,则500mL×1.18g/mL×36%=(500mL×1.18g/mL+x×1g/mL)×11.8% x=1210mL所以答案是:(1)挥发性(2)1210 (3)26.4g
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

【题目】某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下: 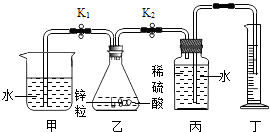
①检查装置气密性,加入锌粒和稀硫酸;
②关闭K2、打开K1 , 待气泡连续均匀产生,立即关闭K1、打开K2 , 并开始计时;
③待丁中收集到10mL水,结束计时;
④换不同溶质质量分数、不同体积的稀硫酸,与质量相同的同一种锌粒重复上述实验;
⑤将每次实验的数据记录于下表:
硫酸用量(mL) | 40 | 40 | 20 | 20 | 20 | 10 | 10 |
硫酸的溶质质量分数(%) | 9.8 | 39.2 | 9.8 | 19.6 | 39.2 | 19.6 | 39.2 |
收集所用时间 | 4′03 | 1′36 | 4′12 | 3′30 | 1′40 | 3′42 | 1′48 |
(1)写出乙中反应的化学方程式:;
(2)该实验的目的是:;
(3)上述实验证明:对该反应中氢气产生的速率有显著影响;
(4)若要快速制取大量氢气,可在乙中加入几滴硫酸铜溶液,但加入的量不可过多,原因是:(用化学方程式表示).
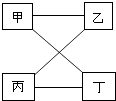
【题目】下表提供的四组物质符合图示相连物质间在一定条件下可以发生反应的是( )
甲 | 乙 | 丙 | 丁 | |
A | CO | O2 | H2SO4 | CuO |
B | Mg | HCl | CuSO4 | NaOH |
C | KOH | SO3 | NaOH | CuSO4 |
D | Na2CO3 | Ca(OH)2 | HCl | CaCl2 |
A.A
B.B
C.C
D.D