题目内容
【题目】全球能源生产正向“氢能经济”转型,以可再生生物资源(如纤维素等)为原料生产氢气已成为能源研究的重点.下图是某新型能源转换与利用模式示意图. 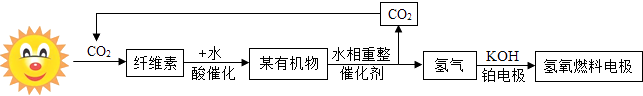
(1)该模式中涉及的能源转化依次为:太阳能→生物质能→氢能→能;
(2)某有机物水相重整制取H2分两步进行反应,其中第一步反应可表示为:CxHyOz→CO+H2 (未配平),则x:z=;
(3)该系统中循环使用的物质是;
(4)氧氧燃料电池工作时,H2和O2在常温下反应.写出该反应的化学方程式:;
(5)与电解水相比.该模式制取氢气的主要优点是: .
【答案】
(1)电
(2)1:1
(3)CO2
(4)2H2+O2=2H2O
(5)节约能源
【解析】解:(1)根据反应流程,最后氢能应用到燃料电池中去,化学能转化为了电能储存起来;(2)有机物水相重整制取H2中第一步反应:CxHyOz→CO+H2 , 可以看出有机物中的碳和氧两种元素均进入到一氧化碳中去,根据原子守恒思想,可知x:z=1:1;(3)根据反应的流程可以看出二氧化碳是可以循环使用的物质;(4)燃料电池的反应就是燃料和氧气的反应,即:2H2+O2=2H2O;(5)电解水产生氢气的方法要消耗大量的电能,而有机物水相重整制取H2的办法会节约大量能源. 所以答案是:(1)电;(2)1:1;(3)CO2;(4)2H2+O2=2H2O;(5)节约能源.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号,以及对氢气的用途和氢能的优缺点的理解,了解氢气可以作为氢能源并具有三大优点:无污染、放热量高、来源广.

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某学习小组对硫酸进行如下研究:
(1)如图中仪器①的名称为 , 发生反应的化学方程式为 . 该装置也可用于实验室制气体(任写一种),化学方程式为 . 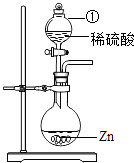
(2)已知相同温度下,硫酸的质量分数越大溶液的酸性越强.常温下18%的稀硫酸的pH2%的稀硫酸(填“>”、“<”或“=”).若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有(填字母). A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
(3)向两个烧杯中分别注入浓硫酸(溶质质量分数为98%,密度为1.84g/m3)和稀硫酸(浓硫酸与水的体积比1:1)各10ml,称量并记录不同时间(h)两种硫酸溶液吸水的质量(g)数据见下表:
时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
吸水质量/g | 浓硫酸 | 1.6 | 2.2 | 6.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
①体积比为1:1稀硫酸的溶质质量分数计算表达式为 . 若量取浓硫酸时俯视读数,则所配稀硫酸的溶质质量分数将(填“偏大”、“偏小”或“不变”)
②由表中实验数据可知:
a.有关硫酸吸水性的说法不正确的是(填字母).
A.浓、稀硫酸都有吸水性 B.只有浓硫酸有吸水性 C.浓硫酸吸水性较稀硫酸强
b.实验室保存稀硫酸时要存放,在干燥气体对应选用硫酸作干燥剂(填“浓”或“稀”).
