题目内容
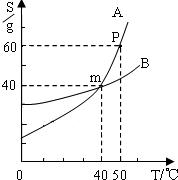 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:(1)曲线A和B的交叉点m表示的含义是
(2)若将A物质从A和B少量的混合物中分离出来,宜采用结晶法中的
(3)将50℃时A、B两种物质的饱和溶液降到40℃,过滤,分离出晶体后,所得溶液溶质质量分数的关系是:A
(4)50℃时将35g A物质加入100g水中,经充分溶解所形成的溶液是
分析:(1)从图形中可以看出,横坐标表示温度,纵坐标为物质的溶解度.A与B的交叉点表示在某温度下溶解度相同.
(2)从图中可以看出A、B的溶解度受温度的影响较大,根据这一特点确定方法.
(3)观察图形看看40℃时AB的溶解度是多少,再根据溶解度的定义计算对比即可得出答案.
(4)观察图形中50℃时A物质的溶解度与35g比较判断;再根据公式:溶液的溶质质量分数=
×100%计算.
(2)从图中可以看出A、B的溶解度受温度的影响较大,根据这一特点确定方法.
(3)观察图形看看40℃时AB的溶解度是多少,再根据溶解度的定义计算对比即可得出答案.
(4)观察图形中50℃时A物质的溶解度与35g比较判断;再根据公式:溶液的溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)从图中可以看出A和B的交叉点m,处在温度为40℃,溶解度为40g的交叉点上.也就是说m点时AB的溶解度相同.所以m点的含义是:在40℃时,A与B物质溶解度相等,均为40g.
(2)从图中可以看出A、B的溶解度受温度的影响较大,可以用冷却热的饱和溶液的方法析出结晶.故答案是:冷却热饱和溶液法.(3)从溶解度曲线图可以看出40℃是AB的溶解度都是40g,即AB的溶剂都是100g,溶质都是40g,根据公式:溶液的溶质质量分数=
×100%可知AB的溶质质量分数相等.故答案为:相等.
(4)从溶解曲线图可以看出,A物质在50℃是的溶解度为60g,35g A物质加入100g水中一定是不饱和溶液.据公式:溶液的溶质质量分数=
×100%得:
×100%=26.0%故答案为:不饱和、26.0%
(2)从图中可以看出A、B的溶解度受温度的影响较大,可以用冷却热的饱和溶液的方法析出结晶.故答案是:冷却热饱和溶液法.(3)从溶解度曲线图可以看出40℃是AB的溶解度都是40g,即AB的溶剂都是100g,溶质都是40g,根据公式:溶液的溶质质量分数=
| 溶质质量 |
| 溶液质量 |
(4)从溶解曲线图可以看出,A物质在50℃是的溶解度为60g,35g A物质加入100g水中一定是不饱和溶液.据公式:溶液的溶质质量分数=
| 溶质质量 |
| 溶液质量 |
| 35 |
| 100+35 |
点评:本题以物质的溶解度曲线图为切入点,考查关于溶解的相关问题.培养学生的识图能力.

练习册系列答案
相关题目
 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: 27、小明同学绘制了如图所示A、B、C三种固体物质的溶解度曲线:
27、小明同学绘制了如图所示A、B、C三种固体物质的溶解度曲线: 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: