题目内容
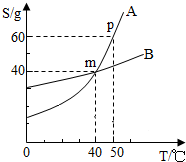 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:(1)当
(2)若将B物质从溶液中结晶析出,宜采用的结晶方法是:
(3)我国有许多盐碱湖,湖中溶有大量的NaCl 和Na2CO3,那里的人们冬天捞碱,夏天晒盐,据此你认为图中(填字母)
(4)在40℃时,将25gA物质加入到盛有50g水的烧杯中,充分搅拌,A溶液中溶质的质量分数是
分析:可根据溶解度曲线的意义进行分析解答.根据溶解度曲线可以判断物质在某一温度时的溶解度大小,可以根据物质溶解度随温度的变化情况判断将不饱和溶液变为饱和溶液所采用的方法,可以判断一定浓度的溶液是否是饱和溶液等.
解答:解:(1)根据溶解度曲线上的某点表示该温度下物质的溶解度的含义可知:m点时二者的溶解度相等,对于温度为40℃
故答案为:40
(2)从曲线上可看出B物质的溶解度随温度变化不大,所以可采用蒸发溶剂法,使B物质析出.
故答案为:蒸发结晶
(3)冬天捞碱即利用降低温度法结晶,夏天晒盐即利用蒸发溶剂法结晶.从曲线可看出A物质溶解度随温度升高快速增大,所以A物质是纯碱.
故答案为:A
(4)在40℃时,A物质的溶解度为40g,即100g水中溶解40g,所以将25gA物质加入到盛有50g水的烧杯中,只有20gA溶解,
所以所得溶液的质量分数为:
×100%=28.6%
若升温到50°C,100g水中可溶解60gA,即50g水中可溶解30gA,所以此时25gA全部溶于50g水中,所以溶液溶质的质量分数为:
×100%=33.3%
故答案为:28.6%;33.3%
故答案为:40
(2)从曲线上可看出B物质的溶解度随温度变化不大,所以可采用蒸发溶剂法,使B物质析出.
故答案为:蒸发结晶
(3)冬天捞碱即利用降低温度法结晶,夏天晒盐即利用蒸发溶剂法结晶.从曲线可看出A物质溶解度随温度升高快速增大,所以A物质是纯碱.
故答案为:A
(4)在40℃时,A物质的溶解度为40g,即100g水中溶解40g,所以将25gA物质加入到盛有50g水的烧杯中,只有20gA溶解,
所以所得溶液的质量分数为:
| 20g |
| 20g+50g |
若升温到50°C,100g水中可溶解60gA,即50g水中可溶解30gA,所以此时25gA全部溶于50g水中,所以溶液溶质的质量分数为:
| 25g |
| 25g+50g |
故答案为:28.6%;33.3%
点评:本题重点考查了学生对溶解度曲线意义的理解,难度不大,但涉及知识点丰富,是一道相等好的试题.

练习册系列答案
相关题目
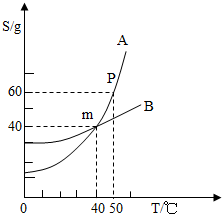 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: 27、小明同学绘制了如图所示A、B、C三种固体物质的溶解度曲线:
27、小明同学绘制了如图所示A、B、C三种固体物质的溶解度曲线: 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: