题目内容
【题目】工业盐酸中通常溶有少量的氯化铁而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸100 g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。请回答下列问题:
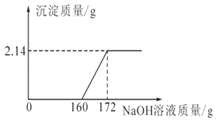
(1)恰好完全反应时,生成沉淀的质量是_____g。
(2)请按上述实验中发生反应的先后顺序写出有关反应的化学方程式:_____;_____。
(3)该工业盐酸中HCl的质量分数是多少_____(写出计算过程)?
【答案】2.14g NaOH+HCl═NaCl+H2O FeCl3+3NaOH═Fe(OH)3↓+3NaCl 29.2%
【解析】
(1)由图可知,完全反应后生成沉淀的质量为2.14g。
(2)酸首先要和氢氧化钠反应,当酸反应完后,氯化铁才和氢氧化钠反应,故有关反应的化学方程式为:NaOH+HCl═NaCl+H2O;FeCl3+3NaOH═Fe(OH)3↓+3NaCl。
(3)由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g﹣160g=12g;
设消耗的氢氧化钠的质量为x。
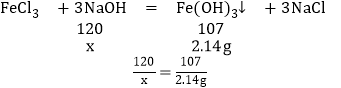
解得x=2.4g。
氢氧化钠溶液的溶质质量分数=![]() =20%
=20%
与盐酸反应的氢氧化钠的质量为:160g×20%=32g
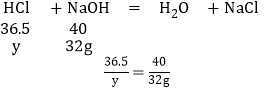
解得y=29.2g
该工业盐酸中HCl的质量分数是:![]() =29.2%
=29.2%
故答案为:
(1)2.14;(2)NaOH+HCl═NaCl+H2O;FeCl3+3NaOH═Fe(OH)3↓+3NaCl;(3)29.2%。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】目前大部分城市居民所使用的燃料主要是管道煤气或天然气,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下:
2CO+O2![]() 2CO2;2H2+O2
2CO2;2H2+O2![]() 2H2O ;CH4+2O2
2H2O ;CH4+2O2![]() CO2+2H2O
CO2+2H2O
(1)根据以上化学方程式判断,相同条件下,燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是__________,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是______进风口(填“增大”或“减小”),如不改进可能产生的不良后果是___________。
(2)家庭煤气管常用硬质聚氯乙烯和聚乙烯塑料管,塑料管属于_______材料。
(3)管道煤气中含有的烃类,除甲烷外还有少量乙烷、丙烷、丁烷等的某些性质见下表:
乙烷 | 丙烷 | 丁烷 | |
熔点/℃ | -183.3 | -189.7 | -183.4 |
沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是:________________。