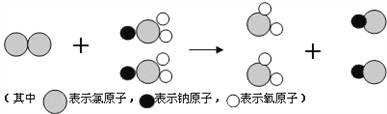
题目内容
【题目】【2015年江苏省苏州市】下列物质间发生的化学反应属于复分解反应的是( )
A.镁条在空气中燃烧生成氧化镁 B.锌粒和稀硫酸反应生成氢气
C.氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀
D.高温煅烧石灰石生成生石灰
【答案】C
【解析】A、镁条在空气中燃烧生成氧化镁,由两种物质生成一种物质,属于化合反应,B、锌粒和稀硫酸反应生成氢气,由一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,错误,C、氢氧化钠溶液和硫酸铜溶液混合生成氢氧化铜沉淀,由两种化合物相互交换成分形成另两种化合物,属于复分解反应,D、高温煅烧石灰石生成生石灰,由一种物质生成两种物质,属于分解反应,故选C

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】某化学研究小组对用过氧化氢溶液分解产生氧气的实验条件进行以下探究。
【知识回忆】写出过氧化氢分解产生氧气的化学方程式:_________________。
【提出问题】 影响过氧化氢分解速率的因素有哪些?
【作出猜想】猜想一:溶液的温度对反应速率有影响;
猜想二:过氧化氢溶液的溶质质量分数对反应速率有影响。
【实验验证】
实验序号 | 温度 | 催化剂 | 过氧化氢溶液 | 实验现象 |
1 | 20 | 无 | 5% 10mL | 无明显现象 |
2 | 50 | 无 | 10mL | 有气泡产生 |
3 | 20 | 0.1g MnO2 | 5% 10mL | |
4 | 20 | 0.2g MnO2 | 10% 10mL |
若用实验1和实验2验证猜想一,则应选用____%过氧化氢溶液 10 mL.根据实验现象说明__________.
若用实验3和实验4验证猜想二,指岀其中一处设计错误_________如果猜想正确,则实验现象是________ 在该实验中,还可以通过测定_____________ 来判断产生氧气的快慢。
【拓展探究】你认为影响过氧化氢分解速率的因素还有__________________(写出一种即可)。
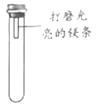
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________
【题目】右下图中, “—”表示相连的物质间在一定条件下可以反应, “→”表示在一定条件下丁可以转化为乙。下面四组选项中符合右下图要求的是( )
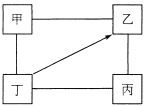
甲 | 乙 | 丙 | 丁 | |
A | H2SO4 | Ba(NO3)2 | NaOH | Na2CO3 |
B | CaCl2 | K2CO3 | Ca(OH)2 | HCl |
C | C | H2O | CO2 | O2 |
D | Al | CuSO4 | Zn | H2SO4 |
A. A B. B C. C D. D