题目内容
【题目】某学习小组对硫酸进行如下研究:
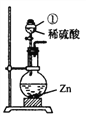
(1)下图中仪器①的名称为_______,发生反应的化学方程式为______________。该装置也可用于实验室制_______气体(任写一种),化学方程式为_______。
(2)已知相同温度下,硫酸的质量分数越大溶液的酸性越强。常温下10%的稀硫酸的pH_______(填“>”“<”或“=”)2%的稀硫酸。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有_______(填字母)。
A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
(3)向两个烧杯中分别注入浓硫酸(溶质质量分数为98%,密度为1.84 g/mL)和稀硫酸(浓硫酸与水的体积比1:1)各10 mL,称量并记录不同时间(h)两种硫酸溶液吸水的质量(g),数据见下表:

①浓硫酸与水体积比为1:1的稀硫酸的溶质质量分数计算表达式为_______。若量取浓硫酸时俯视读数,则所配稀硫酸的溶质质量分数将_______(填“偏大“偏小”或“不变”)。
②由表中实验数据可知:
a.有关硫酸吸水性的说法不正确的是_______(填字母)。
A.浓、稀硫酸都有吸水性
B.只有浓硫酸有吸水性
C.浓硫酸吸水性较稀硫酸强
b.实验室保存稀硫酸时要_______存放,在干燥气体时应选用_______(填“浓”或“稀”)硫酸作干燥剂。
【答案】 分液漏斗 Zn+H2SO4=ZnSO4+H2↑ O2 2H2O2![]() 2H2O+O2↑ < BC
2H2O+O2↑ < BC ![]() ×100% 偏小 B 密封 浓
×100% 偏小 B 密封 浓
【解析】(1)、实验室制取氢气、二氧化碳、氧气都可用固液常温型装置;根据化学方程式的书写规则书写;(2)、根据溶液的酸碱性与酸碱度之间的关系分析;(3)、①根据溶质质量分数的计算公式计算体积比为1:1稀硫酸的溶质质量分数;根据量取俯视读数时实际量取的浓硫酸的量分析配置的稀硫酸的溶质质量分数的变化;②a根据分析表中的数据,分析硫酸的吸水性;b根据浓硫酸的吸水性分析。解:(1)、仪器①的名称为:分液漏斗;锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;该装置是固液常温型装置,实验室还可用此装置制取氧气,化学方程式为:2H2O2 MnO2 2H2O+O2↑;(2)、因为相同温度下,硫酸的质量分数越大溶液的酸性越强,溶液的pH越小,所以常温下18%的稀硫酸的pH<2%的稀硫酸;向稀硫酸中加入铁粉时,铁和硫酸反应,酸性转减弱,溶液的pH要增大,向稀硫酸中加入氢氧化钾时,氢氧化钾和硫酸反应,溶液的pH要增大,所以,溶液的pH因化学变化而升高的有 BC;(3)、①要配置体积比为1:1稀硫酸,设取溶质质量分数为98%的浓硫酸的体积为v,取水的体积也为v,则体积比为1:1稀硫酸的溶质质量分数计算表达式为:![]() ×100%=
×100%=![]() ×100%;在量取时浓硫酸时是俯视读数,实际量取的浓硫酸少了,所配置的稀硫酸的质量分数偏小;②a由表中的数据可知:浓、稀硫酸都有吸水性,浓硫酸的吸水性比稀硫酸的吸水性强,故选B;b由于浓硫酸有吸水性,所以,浓硫酸在保存时要密封保存,可用作某些气体的干燥剂。
×100%;在量取时浓硫酸时是俯视读数,实际量取的浓硫酸少了,所配置的稀硫酸的质量分数偏小;②a由表中的数据可知:浓、稀硫酸都有吸水性,浓硫酸的吸水性比稀硫酸的吸水性强,故选B;b由于浓硫酸有吸水性,所以,浓硫酸在保存时要密封保存,可用作某些气体的干燥剂。