题目内容
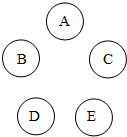 (2012?哈尔滨)A、B、C、D、E分别为稀硫酸、氧化铜、硝酸钡溶液、碳酸钾溶液、镁条中的一种物质.其中A形成浓溶液后有强烈的腐蚀性,B为单质,C为黑色粉末,D中的溶质为草木灰的成分之一.请回答下列问题:
(2012?哈尔滨)A、B、C、D、E分别为稀硫酸、氧化铜、硝酸钡溶液、碳酸钾溶液、镁条中的一种物质.其中A形成浓溶液后有强烈的腐蚀性,B为单质,C为黑色粉末,D中的溶质为草木灰的成分之一.请回答下列问题:(1)将五种物质的名称填入图中相应的位置,并将能发生化学反应的两种物质间用短线“--”相连接;
(2)写出A与E发生反应的化学方程式
H2SO4+Ba(NO3)2═BaSO4↓+2HNO3
H2SO4+Ba(NO3)2═BaSO4↓+2HNO3
;(3)写出A与B发生反应的实验现象
银白色固体表面产生气泡,固体减少(或消失),同时放出热量
银白色固体表面产生气泡,固体减少(或消失),同时放出热量
.分析:(1)根据物质的化学性质可以将物质的名称填入有图中,注意联系各物质的性质,尽可能的将能发生反应的物质都连接上;
(2)根据图中所填的物质写出反应的化学方程式即可;
(3)根据图中所填的A和B发生反应时的现象来完成解答.
(2)根据图中所填的物质写出反应的化学方程式即可;
(3)根据图中所填的A和B发生反应时的现象来完成解答.
解答:解:(1)分析所给的物质可以知道硫酸可以跟剩余的四种物质发生反应,所以可以将A定为硫酸,那么B为镁条,C为氧化铜,D为碳酸钾溶液,E为硝酸钡溶液,其中硝酸钡溶液合碳酸钾溶液也能反应生成白色沉淀,故可以得出它们的关系如下图:
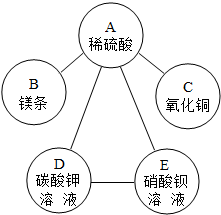
(2)A为硫酸,E为硝酸钡,它们反应的化学方程式为:H2SO4+Ba(NO3)2═BaSO4↓+2HNO3;
(3)A为硫酸,B为镁条,它们反应生成了氢气,所以可以看到在金属的表面产生气体,并且固体减少,同时放出热量.
故答案为:(1)如图所示
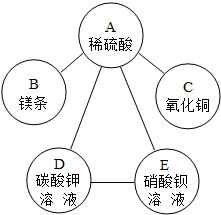
(2)H2SO4+Ba(NO3)2═BaSO4↓+2HNO3;
(3)银白色固体表面产生气泡,固体减少(或消失),同时放出热量.

(2)A为硫酸,E为硝酸钡,它们反应的化学方程式为:H2SO4+Ba(NO3)2═BaSO4↓+2HNO3;
(3)A为硫酸,B为镁条,它们反应生成了氢气,所以可以看到在金属的表面产生气体,并且固体减少,同时放出热量.
故答案为:(1)如图所示

(2)H2SO4+Ba(NO3)2═BaSO4↓+2HNO3;
(3)银白色固体表面产生气泡,固体减少(或消失),同时放出热量.
点评:熟练掌握常见的酸碱盐的化学性质,能够根据复分解反应发生的条件判断反应能否进行,并能够正确的书写化学方程式.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目

 (2012?哈尔滨模拟)财政部国家税务总局发出通知,自2012年1月1日起,对使用新能源的汽车船舶,免征车船税.实施这种政策的目的是(1)
(2012?哈尔滨模拟)财政部国家税务总局发出通知,自2012年1月1日起,对使用新能源的汽车船舶,免征车船税.实施这种政策的目的是(1) (2012?哈尔滨模拟)A、B、C、D分别是铁粉、硫酸铜溶液、氢氧化钠溶液、稀盐酸中的一种物质.请同答下列问题:
(2012?哈尔滨模拟)A、B、C、D分别是铁粉、硫酸铜溶液、氢氧化钠溶液、稀盐酸中的一种物质.请同答下列问题: