题目内容
【题目】(6分)实验室有一瓶标签受到腐蚀(如图所示)的无色溶液,老师叫各小组开展探究。
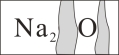
【提出问题】这瓶无色溶液究竟是什么物质的溶液?
【猜想与假设】经了解得知,这瓶无色溶液原是放在存放盐溶液的柜子里。由此猜测:可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液。
【理论分析】为了确定该溶液,他们首先进行了分析:
(1)甲同学根据标签上的组成元素认为一定不可能是____溶液。
(2)乙同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是____。
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验。
实 验 操 作 | 实 验 现 象 |
①取少量该无色溶液于试管中,慢慢滴加BaCl2溶液。 ②静置后,倾去上层清液,向沉淀中滴加稀盐酸。 | 产生白色沉淀。 产生大量气泡,沉淀消失。 |
【实验结论】
(3)该瓶无色溶液的溶质是____。生成白色沉淀的化学方程式是____。
【实验反思】
(4)丙同学认为原设计的实验还可简化,同样达到鉴别的目的。丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
实 验 操 作 | 实 验 现 象 |
【答案】【理论分析】(1)氯化钠(或NaCl);
(2)碳酸氢钠和硝酸钠的化学式中钠的原子个数为1,而标签中为2;(或碳酸氢根和硝酸根化合价为-1价,而标签中显示推断酸根为-2价)
【实验结论】(3)碳酸钠(或Na2CO3);Na2CO3+BaCl2=BaCO3↓+2NaCl;
【实验反思】(4)
实 验 操 作 | 实 验 现 象 |
取少量无色溶液于试管中,向其中滴加稀盐酸 | 有大量气泡产生 |
【解析】
试题分析:【理论分析】该物质中含有氧元素,氯化钠不含氧元素,故不可能是氯化钠;钠元素显+1价,根据在化合物中正负化合价代数和为0的原则可知阴离子为-2价,故根据标签上信息可知该物质不是碳酸氢钠、硝酸钠;
【实验结论】碳酸钠与氯化钡反应生成的是碳酸钡沉淀,碳酸钡能与酸反应生成二氧化碳气体;硫酸钠与氯化钡反应生成硫酸钡沉淀,硫酸钡沉淀不溶于酸。根据实验现象可知生成的沉淀是碳酸钡,即该物质是碳酸钠;
【实验反思】要判断是碳酸钠还是硫酸钠,实际上是要判断含有硫酸根还是碳酸根,那么可直接加入稀盐酸,若会产生大量的气泡,则说明是碳酸钠,若没有气泡产生则说明是硫酸钠。