题目内容
【题目】(8分)铜跟浓硫酸的反应原理是:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。某小组同学用下图所示装置制取硫酸铜。请回答以下问题:
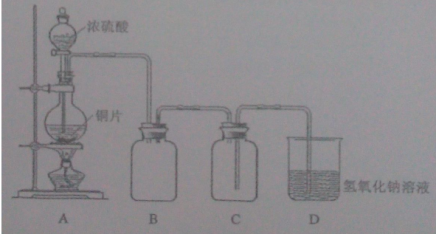
(1)图中B装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,请在答题纸上将B装置中的导管补画完整。
(2)图中C装置的作用是防止氢氧化钠溶液倒吸入B瓶中,装置D的作用是____
(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验。
实验1:用pH试纸测试滤液pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,____可说明硫酸有剩余。(选填“实验1”或“实验2”)
(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有____(答出两点即可。)
【答案】
(1)  (2)吸收SO2(3)实验1、可说明硫酸有剩余。(4)缺陷:产生有环境污染的气体原料利用率低 浓硫酸具有强腐蚀性反应需加热不节能
(2)吸收SO2(3)实验1、可说明硫酸有剩余。(4)缺陷:产生有环境污染的气体原料利用率低 浓硫酸具有强腐蚀性反应需加热不节能
【解析】
试题分析:(1)因为生成的二氧化硫的密度比空气的大,故左端的导管要深入到集气瓶底部;(2)因为二氧化硫是空气污染物,装置D的作用是吸收多余的二氧化硫,防止空气污染;(3)根据实验的操作可知实验1证明溶液内有氢离子,;(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有产生有环境污染的气体原料利用率低 浓硫酸具有强腐蚀性反应需加热不节能。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目