题目内容
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子镁离子氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是________(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH=1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想1:只含NaCl;猜想2: _________;猜想3:NaClNaHCO3
(设计实验)
实验步骤实验现象实验结论:
实验一取一定量反应后的溶液于试管中,滴加________,无明显现象猜想3错误;
实验二另取一定量反应后的溶液于试管中,_______________________,猜想2正确;
实验二中涉及反应的化学方程式为________________。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生CO2的速率快慢和中和酸的能力强弱。
如图1,利用数字化实验分别测定碳酸氢钠片铝碳酸镁片与“胃酸”反应时,产生CO2的速率快慢和pH的变化,得到“二氧化碳浓度与时间”曲线(如图2)“pH与时间”曲线(如图3)。
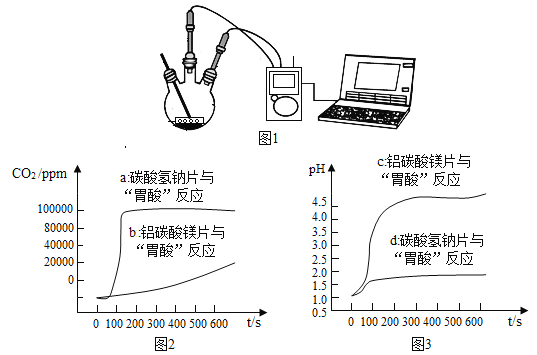
(1)服用碳酸氢钠片更易造成胃胀气,原因是________。
(2)铝碳酸镁片中和酸的能力更强,理由是________。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。
【答案】![]() 、
、![]() 、NaClHCl 无色酚酞试液 加入锌粒,有气泡产生
、NaClHCl 无色酚酞试液 加入锌粒,有气泡产生 ![]() 碳酸氢钠与胃酸反应使二氧化碳的浓度迅速增大 铝碳酸镁片与胃酸反应pH由1迅速升至4.5左右
碳酸氢钠与胃酸反应使二氧化碳的浓度迅速增大 铝碳酸镁片与胃酸反应pH由1迅速升至4.5左右
【解析】
[查阅资料]
(1)铝碳酸镁片中含有铝离子镁离子氢氧根离子和碳酸根离子。根据酸碱反应原理,氢氧根离子能与氢离子反应生成水;依据碳酸盐与酸反应的原理,碳酸根离子与氢离子反应生成二氧化碳气体和水,故该药物起抗酸作用的微粒是![]() 、
、![]() 。
。
[作出猜想]
当碳酸氢钠与盐酸恰好完全反应时,则猜想1:只含NaCl;当碳酸氢钠与盐酸反应,盐酸过量时,则猜想2:NaClHCl;当碳酸氢钠与盐酸反应,碳酸氢钠过量时,则猜想3:NaClNaHCO3。
[设计实验]
实验一取一定量反应后的溶液于试管中,滴加无色酚酞试液,溶液无明显现象,溶液不呈碱性,溶液不含碳酸氢钠,则猜想3错误。
实验二另取一定量反应后的溶液于试管中,加入锌粒,有气泡产生,溶液中有盐酸,则猜想2正确。
实验二中涉及反应是锌与盐酸反应,化学方程式为![]() 。
。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生CO2的速率快慢和中和酸的能力强弱。
(1) 根据“二氧化碳浓度与时间”曲线可知,服用碳酸氢钠片更易造成胃胀气,原因是碳酸氢钠与胃酸反应使二氧化碳的浓度迅速增大。
(2)根据 “pH与时间”曲线可知,铝碳酸镁片中和酸的能力更强,理由是铝碳酸镁片与胃酸反应pH由1迅速升至4.5左右。

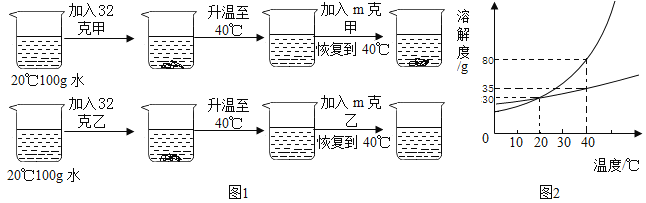
【题目】已知 KNO3的溶解度如下表所示,下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
A.在 10℃-70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100 g 水中加入 35 g KNO3,充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%
【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。