题目内容
【题目】甲、乙试管中各盛有10.0g 水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。下列说法正确的是
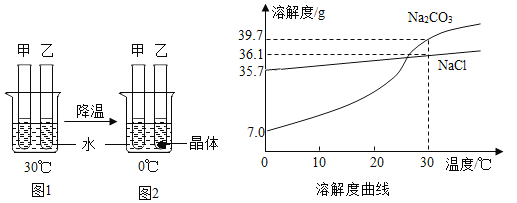
A.甲中加入的粉末是Na2CO3
B.0℃时,甲中溶液一定不饱和,乙中溶液一定饱和
C.Na2CO3中含有少量NaCl,可采用蒸发结晶的方法来提纯Na2CO3
D.30℃时,若使图1中甲、乙试管内的溶液都恰好变为饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
【答案】B
【解析】
A、由溶解度曲线可知,0℃时,Na2CO3的溶解度是7.0g,NaCl的溶解度是35.7g。根据溶解度,0℃时10.0g水中只能溶解0.7g Na2CO3,原来30℃时溶有3.0g,因此降温至0℃有晶体析出;而0℃时10.0g水中最多能溶3.57g NaCl粉末,原来30℃时溶有3.0g,降温至0℃没有达到饱和状态,没有晶体析出。根据图2中甲试管中没有晶体,而乙试管中有晶体析出,可以判断甲中加入的粉末是NaCl粉末,乙中加入的粉末是Na2CO3,选项A不正确;
B、根据溶解度曲线,0℃时10.0g水中最多能溶3.57g NaCl粉末,原来30℃时溶有3.0g,降温至0℃没有达到饱和状态,而0℃时10.0g水中只能溶解0.7g Na2CO3,原来30℃时溶有3.0g,因此降温至0℃有晶体析出,得到的溶液一定是0℃的饱和溶液,选项B正确;
C、因为碳酸钠的溶解度随温度升高而增大,且变化较大,NaCl的溶解度受温度影响较小,所以Na2CO3 中含有少量NaCl,应采用冷却热饱和溶液的方法来提纯Na2CO3,选项C不正确,
D、30℃时,碳酸钠的溶解度是39.7g,氯化钠的溶解度是36.1g,30℃时10.0g 水中最多能溶碳酸钠3.97g,氯化钠3.61g,而原来试管内加入的溶质都是3.0g,若使图1中甲、乙试管内的溶液都恰好变为饱和溶液,甲是氯化钠,乙是碳酸钠,因此甲中加入对应的溶质质量小于乙中加入对应的溶质质量,选项D不正确。故选B。