题目内容
【题目】在实验室里,小明看到氢氧化钠试剂瓶口有白色粉末,为探究其成分,他取少量该粉末溶于水,得到无色溶液,进行了如下实验,请结合实验回答下列问题。
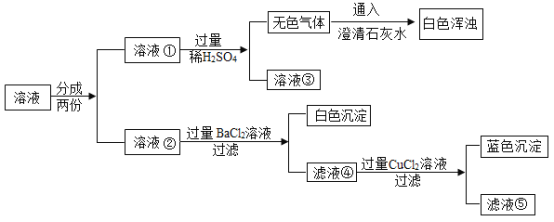
(1)该白色粉末的成分是_____;
(2)在溶液②中加过量![]() 溶液的目的是_____;
溶液的目的是_____;
(3)实验中,用_____溶液代替![]() 溶液也能达到实验目的;
溶液也能达到实验目的;
(4)实验后,将溶液③和滤液⑤都倒入同一个废液缸中,静置后,缸底有白色沉淀,取少量上层溶液,向其中加适量的![]() 溶液,无明显变化。综合分析,废液缸里上层溶液中一定含有的物质是_____,确定“一定不含的物质”所依据的现象是_____。
溶液,无明显变化。综合分析,废液缸里上层溶液中一定含有的物质是_____,确定“一定不含的物质”所依据的现象是_____。
【答案】氢氧化钠和碳酸钠 为了除尽溶液中的碳酸钠 无色酚酞 氯化钠 加适量的Na2SO4溶液,无明显变化
【解析】
根据无色气体能使澄清石灰水变浑浊,所以该气体是二氧化碳,溶液①和硫酸反应生成二氧化碳,所以样品中一定含有碳酸钠,溶液③中含有氯化钠、硫酸钠和硫酸;溶液②中加入溶液氯化钡会生成白色沉淀,所以溶液④中含有氯化钡、氯化钠、氢氧化钠,加入溶液氯化铜生成氢氧化铜沉淀,所以样品中一定含有氢氧化钠,溶液⑤中含有氯化钡、氯化钠、氯化铜,然后结合选项进行解答。
无色气体能使澄清石灰水变浑浊,所以该气体是二氧化碳,溶液①和硫酸反应生成二氧化碳,所以样品中一定含有碳酸钠,溶液③中含有氯化钠、硫酸钠和硫酸;溶液②中加入溶液氯化钡会生成白色沉淀,所以溶液④中含有氢氧化钠、氯化钡、氯化钠,加入溶液氯化铜生成氢氧化铜沉淀,所以样品中一定含有氢氧化钠,溶液⑤中含有氯化钡、氯化钠、氯化铜,所以
(1)该白色粉末的成分是氢氧化钠和碳酸钠;
(2)在溶液②中加过量BaCl2溶液的目的是:为了除尽溶液中的碳酸钠;
(3)该白色粉末的成分是氢氧化钠和碳酸钠;在溶液②中加过量BaCl2溶液,除尽溶液中的碳酸钠;酚酞遇碱变红色,所以实验中用无色酚酞溶液代替CuCl2溶液也能达到实验目的;
(4)溶液③中含有氯化钠、硫酸钠和硫酸,溶液⑤中含有氯化钡、氯化钠、氯化铜,实验后,将溶液③和滤液⑤都倒入同一个废液缸中,静置后,缸底有白色沉淀。取少量上层溶液,向其中加适量的Na2SO4溶液,无明显变化,综合分析,废液缸里上层溶液中一定含有的物质是氯化钠,一定不含的物质是氯化钡,确定“一定不含的物质”所依据的现象是加适量的Na2SO4溶液,无明显变化。
故答案为:(1)氢氧化钠和碳酸钠;
(2)为了除尽溶液中的碳酸钠;
(3)无色酚酞;
(4)氯化钠;加适量的Na2SO4溶液,无明显变化。

 阅读快车系列答案
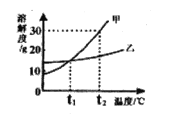
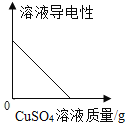
阅读快车系列答案【题目】下表实验内容中的横、纵坐标表示的量符合下图所示变化趋势的是
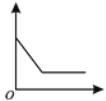
序号 | 实验内容 | 横坐标表示的量 | 纵坐标表示的量 |
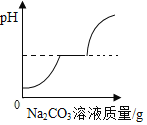
① | 盐酸加水稀释 | 加入水的体积 | 溶液的pH |
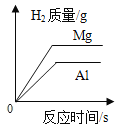
② | 过量红磷测定空气中氧气含量 | 时 间 | 红磷质量 |
③ | 过氧化氢溶液与二氧化锰制氧气 | 时 间 | 二氧化锰质量 |
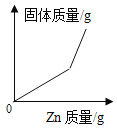
④ | 向铜、锌混合物粉末中加入盐酸 | 盐酸质量 | 剩余固体质量 |
A.①②B.①④
C.②③D.②④
【题目】![]() 为绿色氧化剂,为了便贮存运输,工业上采用“醇析法”将其转化成固态过碳酸钠晶体(化学式为
为绿色氧化剂,为了便贮存运输,工业上采用“醇析法”将其转化成固态过碳酸钠晶体(化学式为![]() ),过碳酸钠溶于水时又分解生成碳酸钠和过氧化氢。
),过碳酸钠溶于水时又分解生成碳酸钠和过氧化氢。
(1)“醇析法”生产的工艺流程如下:
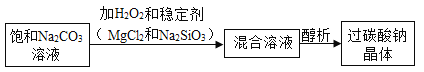
写出生成过碳酸钠晶体的化学方程式:_____。
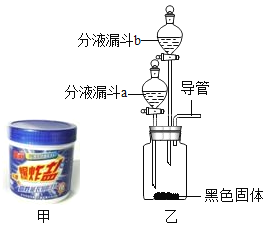
(2)图甲是一种名为“污渍爆炸盐”的洗涤品,能高效去污。小健同学欲通过实验验证其主要成分。
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠。
(设计与实验)
小健同学设计的主要实验装置如图乙所示,请你运用初中所学知识,帮助小健同学完成下列实验报告。
序号 | 主要操作步骤 | 主要实验现象 |
① | 在集气瓶中加入少量_____(黑色固体); 在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液; 在分液漏斗b中加入_____溶液(以上两空均填化学式) | |
② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞 | 立即产生大量气泡 |
然后用_____接近导管口 | _____ | |
结论:“污渍爆炸盐”溶于水生成_____(填物质名称) | ||
③ | 待第②步反应停止后,打开分液漏斗b的活塞,放出足量溶液后,关闭活塞 | 产生白色沉淀 |
结论:“污渍爆炸盐”溶于水生成_____(填物质名称) | ||
(实验反思)
①保存“污渍爆炸盐”时要注意_____(写一条)。
②为了进一步确定“污渍爆炸盐”中过碳酸钠的含量,可选择的条件有_____(选填字母)。
A 产生的气体的质量
B 产生的白色沉淀的质量
C 分液漏斗a中液体的质量
D 分液漏斗b中液体的质量