题目内容
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为 __________)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应_______________热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳
②氧化镁与过氧化氢反应放出大量的热
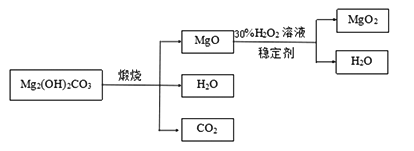
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是_________________。
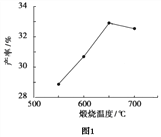
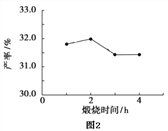
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与 30% 双氧水反应合成过氧化镁产率(见图1和图2)。碱式碳酸镁煅烧的温度适宜控制在______℃,煅烧的时间适宜控制在_____h。
(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因__________。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
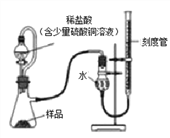
检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
【答案】 -1价 2MgO2![]() 2MgO+O2↑ 放热 取少量煅烧后的固体,滴入稀盐酸,无气泡产生 防止过氧化氢受热分解或防止过氧化镁受热分解 650 2 700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分 作过氧化氢分解的催化剂(答到催化作用给分) 80% B
2MgO+O2↑ 放热 取少量煅烧后的固体,滴入稀盐酸,无气泡产生 防止过氧化氢受热分解或防止过氧化镁受热分解 650 2 700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分 作过氧化氢分解的催化剂(答到催化作用给分) 80% B
【解析】一、过氧化镁的性质(1)过氧化镁中镁元素显+价,设氧元素的化合价为x,则+2+2x=0,故(氧元素的化合价为-1价)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。化学方程式为:2MgO2 ![]() 2MgO+O2↑;(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应放出热量;二、过氧化镁的制备:(3)检测煅烧过程碱式碳酸镁完全分解的方法是取少量煅烧后的固体,滴入稀盐酸,无气泡产生;上述生产过程加入稳定剂的作用是防止过氧化氢受热分解或防止过氧化镁受热分解;(4)由图是信息可知,在温度650和2小时时产率达到最高值,故碱式碳酸镁煅烧的温度适宜控制在650℃,煅烧的时间适宜控制在2h;(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因:700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分;三、过氧化镁产品纯度检测:(6)稀盐酸中放入的少量硫酸铜溶液目的是:作过氧化氢分解的催化剂;(7) 设样品中过氧化镁的质量为
2MgO+O2↑;(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应放出热量;二、过氧化镁的制备:(3)检测煅烧过程碱式碳酸镁完全分解的方法是取少量煅烧后的固体,滴入稀盐酸,无气泡产生;上述生产过程加入稳定剂的作用是防止过氧化氢受热分解或防止过氧化镁受热分解;(4)由图是信息可知,在温度650和2小时时产率达到最高值,故碱式碳酸镁煅烧的温度适宜控制在650℃,煅烧的时间适宜控制在2h;(5)结果分析:在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因:700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分;三、过氧化镁产品纯度检测:(6)稀盐酸中放入的少量硫酸铜溶液目的是:作过氧化氢分解的催化剂;(7) 设样品中过氧化镁的质量为![]() ,反应后刻度管度数为122mL,故生成氧气的体积为122 mL-10 mL=112 mL,由MgO2+2HCl=MgCl2+H2O2,2H2O2
,反应后刻度管度数为122mL,故生成氧气的体积为122 mL-10 mL=112 mL,由MgO2+2HCl=MgCl2+H2O2,2H2O2![]() 2H2O+O2↑得,
2H2O+O2↑得,
2MgO2~~~~~~ O2
112 32
![]() 1.429g/L
1.429g/L![]()
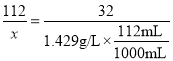
![]() =0.56g
=0.56g
所以样品中过氧化镁的质量分数为: ![]() ; (8)该小组同学所测得质量分数比实际结果偏大,可能的原因是:A、生成的氧气有少量溶于水,会使测得的过氧化镁质量减小,质量分数减小;B、未等装置冷却到室温就开始读数,由于气体受热膨胀,会使侧得的氧气体积增大,过氧化镁质量增大,故是样品中过氧化镁的质量分数增大;C、杂质与盐酸反应能产生少量的气体,会使氧气的体积偏小,会使测量结果偏小;D、滴入的稀盐酸占了一部分气体的体积,导致氧气的实际体积偏小,会使测量结果偏小。
; (8)该小组同学所测得质量分数比实际结果偏大,可能的原因是:A、生成的氧气有少量溶于水,会使测得的过氧化镁质量减小,质量分数减小;B、未等装置冷却到室温就开始读数,由于气体受热膨胀,会使侧得的氧气体积增大,过氧化镁质量增大,故是样品中过氧化镁的质量分数增大;C、杂质与盐酸反应能产生少量的气体,会使氧气的体积偏小,会使测量结果偏小;D、滴入的稀盐酸占了一部分气体的体积,导致氧气的实际体积偏小,会使测量结果偏小。