��Ŀ����
����Ŀ������֪ʶ��Լ��Դ ������������������������й㷺��Ӧ�á���ش��������⣺
��1����˿��������������еĵ�˿�������˸ý���____________�����ʡ� ����˿��Ǧ��Ͻ𣩱�������Ĵ��������۵�_____________��ѡ��������������������
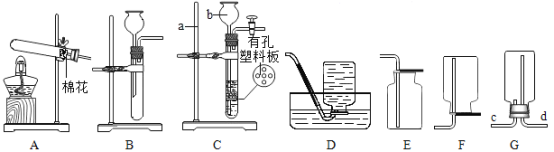
��2����ͼ��ʾװ����̽���������ʵ�飬ʵ��������Ƭ��״����С��ͬ��������д�ո�
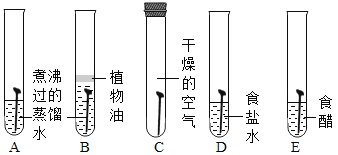
��һ��ʱ����Թ� A ����Ƭ���⣬�Թ� B �� C ����Ƭ���ֹ������Թ� D �� E ����Ƭ���ⶼ���Թ�A�ࡣȫ��۲��Թ� ABC ���������������ó����ۣ�������ʴ��Ҫ����������е�_____________��ͬ���õĽ����
�ڶԱ��Թ� A��E ����ʵ������ǣ�___________��
�������к��߱Ⱥӱߵ�����Ʒ���������⣬�Ӷ��²��Ȼ����ܼӿ�������ʴ��Ϊ��֤���룬Ӧ����ʵ����_______��ѡ���Թܱ�ţ���
��3���ҹ�ÿ�걨�ϵ��ֻ����� 1 �ڲ����Ͼ��ֻ��ĵ�·���к���ͭ����������������ȶ��ֽ��������ⶪ���Ȼ������Դ�˷ѣ�Ҳ����Ⱦ������ˮ�塣��ѧС��Ϊ�������е�ͭ����Ʋ�����������ʵ�顣��֪�� Cu+H2O2+H2SO4=CuSO4+2H2O�������ǽ����������Ʒ�Ӧ��

��д��һ��������з�����Ӧ�Ļ�ѧ����_____________��
����Һ A �е���������_____________����д���ӷ��ţ���
����Һ C ��һ�����е�������_____________��
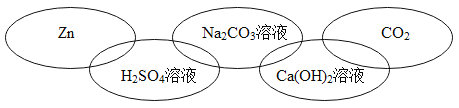
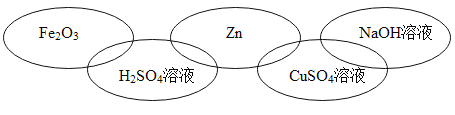
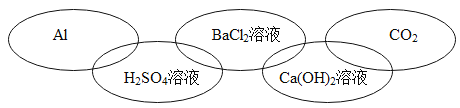
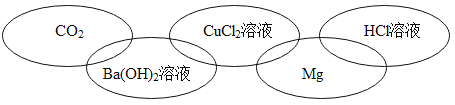
���𰸡��۵�� �� ������ˮ ��������ڵĻ����и������� AD Fe+H2SO4�TFeSO4+H2����2Al+3H2SO4�TAl 2(SO4)3+3H2�� Al3+��Fe2+��H+ H2SO4 H2O2 CuSO4
��������
��1����˿��������������еĵ�˿�������˸ý����۵�ߵ����ʣ��Ͻ���۵�һ���������ɴ��������۵㣬����˿��Ǧ��Ͻ𣩱�������Ĵ��������۵�͡�
��2����A�Թ�������������ˮ��ͬ�Ӵ���B�Թ�ֲ�����赲����������е������Ӵ���C�Թ���������ˮ�Ӵ���ȫ��۲��Թ� ABC �����������Թ� A ����Ƭ���⣬�Թ� B �� C ����Ƭ���ֹ�����˵����������Ҫ����������е�������ˮ��ͬ���õĽ����
��A�Թ�������������ˮ��ͬ�Ӵ���E�Թ���������ᡢˮ�������Ӵ����Թ� A ����Ƭ���⣬�Թ�E ����Ƭ������Թ�A�ࡣ˵����������ڵĻ����и������⡣
��A�Թ�������������ˮ��ͬ�Ӵ���D�Թ��������Ȼ��ơ�ˮ�������Ӵ����Թ� A ����Ƭ���⣬�Թ�D ����Ƭ������Թ�A�ࡣ˵�������Ȼ��ƴ��ڵĻ����и������⡣ͨ��AD����ʵ��ȽϿ�֪�����к��߱Ⱥӱߵ�����Ʒ���������⣬�Ӷ��²��Ȼ����ܼӿ�������ʴ��
��3���ٲ����������ϡ���ᷴӦ����������������������ѧ����ʽ��Fe+H2SO4�TFeSO4+H2����ϡ���������Ӧ������������������2Al+3H2SO4�TAl 2(SO4)3+3H2����������ͭ��ϡ�����Ӧ��
��ϡ���������Ӧ��������������������ϡ���������Ӧ����������������������������ǹ����ģ�������ҺA�е���������Al3+��Fe2+��H+��
��������B�����н�����ͭ���м�������ϡ�������������Һ������Cu+H2O2+H2SO4=CuSO4+2H2O��ͭ������Ӧ����Ӧ����ˣ���Һ C ��һ�����е������ǹ�����H2SO4�� H2O2�ͷ�Ӧ���ɵ�����ͭ��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
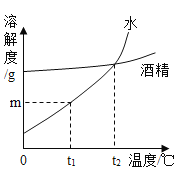
��һ������ĩ�ٷֳ�̾�ϵ�д�����Ŀ���������ڶ�����������Դʮ�ַḻ���Ӻ�ˮ����ȡ�Ȼ��Ʋ����Ȼ��ƺ�ˮΪԭ����ȡ�������ơ����������ʵĹ�������ͼ���£�
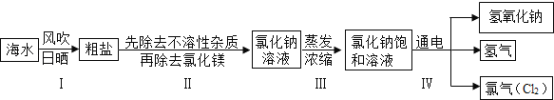
ij��ȤС���������ʵ�飺
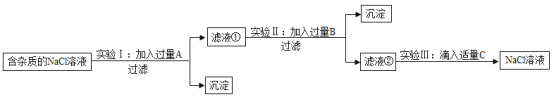
��ʵ��һ����ȥ�����еIJ���������
����һ����������ƽ��ȡ5.0g���Σ���ҩ���ô�������ʢ10mLˮ���ձ��У��ӱ��ò��������裬һֱ�ӵ����β����ܽ�Ϊֹ������ʣ�µĴ�������Ϊ1.4g
��������������ˡ��������õ�3.2g���Σ�
��1�����㾫�εIJ���_________������һλС������
��2����С���õIJ���ƫ�ͣ����ܵ�ԭ����________��
A�ܽ�ʱδ��ֽ���
B����ʱˮ��δ����
C����ʱ��������������
��3������һ�����IJ��ֲ�����ͼ��ʾ�����д������_________������ĸ��ţ���
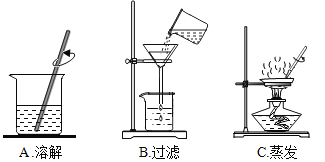
��ʵ�����̽����������ͼ���������õ��Ȼ�����Һ��MgCl2�Ƿ��������Һ���Ƿ���CaCl2
[��������]�й����ʵ��ܽ��Ա���20����
������ | OH�� |
|
Ca2+ | | �� |
Mg2+ | �� | |
[����ʵ��]���������ǹ�ͬ��ɣ����ش����������⣺
ʵ�鲽�� | ʵ������ | ʵ����� |
����һ��ȡһ�������Ȼ�����Һ���Թ��У�����������NaOH��Һ | ���������� | ˵��MgCl2______��������������δ�������� |
�������������һ������Һ�м���������______��Һ | ������ɫ���� | ˵����Һ�к���CaCl2 |
[��չ˼ά]
��1����������ͼ�������Ӻ�ˮ�еõ����Σ����÷紵��ɹ�����ܼ��ķ����������Dz��ý�����Һ�¶ȵķ�����ԭ����________________________________��
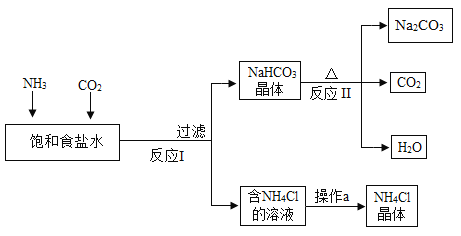
��2��д����������ͼ�������Ļ�ѧ����ʽ__________________________��