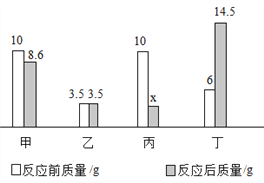
题目内容
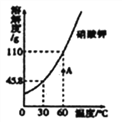
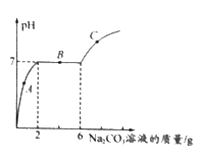
【题目】往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验事实绘制如图所示曲线,下列说法不正确的是( )
A. a点至b点之间的溶液中溶质种类最多,c点的溶液所含的溶质种类最少
B. d点的溶液能使紫色石蕊溶液变蓝
C. c至d段,溶液pH不断增大
D. ab段的反应无明显现象,bc段的反应中有白色沉淀产生
【答案】D
【解析】向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程中氢氧化钠先与硫酸反应,然后与硫酸铜反应。A、a点至b点之间的反应是硫酸和氢氧化钠反应生成硫酸钠和水,溶液中的溶质为:硫酸、硫酸钠、硫酸铜,溶液中溶质种类最多,c点是氢氧化钠和硫酸、硫酸铜完全反应,溶液所含的溶质是硫酸钠,溶质种类最少,正确;B、d点表示加入的氢氧化钠过量,溶液能使紫色石蕊溶液变蓝,正确;
C、c点表示氢氧化钠和硫酸、硫酸铜完全反应,c至d段表示逐渐加入氢氧化钠,溶液pH不断增大,正确;D、ab段的反应是氢氧化钠和硫酸反应生成硫酸钠和水,无明显现象,bc段的反应是硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,有蓝色沉淀产生,错误。故选D。

 小学教材全测系列答案
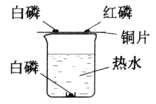
小学教材全测系列答案【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:

①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。