题目内容
【题目】以FeSO4为原料制备铁黑颜料Fe3O4(其中Fe元素既有+2价,也有+3价)的过程如下图。
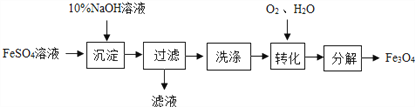
“转化”过程的反应为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 。若原料中含FeSO4 4.56t,请计算:
(1)该方法理论上最终可以获得Fe3O4的质量。
(2)理论上与FeSO4反应的NaOH溶液的质量(写出计算过程)。
【答案】(1)2.32 ; (2)24t
【解析】本题主要考查了根据化学方程式的计算。
(1)因为硫酸亚铁中的铁元素完全转化到了四氧化三铁中,因此该方法理论上最终可以获得Fe3O4的质量为:(4.56t×![]() ×100%)÷(
×100%)÷( ![]() ×100%)=2.32t,
×100%)=2.32t,
(2)设:反应的氢氧化钠质量为x,
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
152 80
4.56t x
![]() =
=![]()
x=2.4t,
理论上与FeSO4反应的NaOH溶液的质量为:2.4t÷10%=24t,
答:(1)该方法理论上最终可以获得Fe3O4的质量为2.32t
(2)理论上与FeSO4反应的NaOH溶液的质量为24t。

 阅读快车系列答案
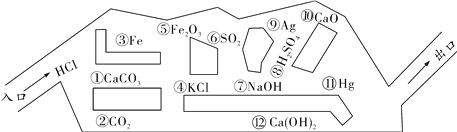
阅读快车系列答案【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
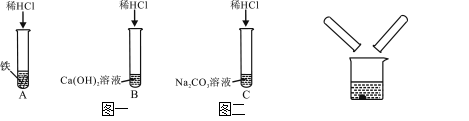
(1)A试管中的反应现象是 。
(2)C试管中反应的化学方程式是 。
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:有NaCl
乙同学猜想:有NaCl、CaCl2
丙同学猜想:有NaCl、CaCl2、 HCl
你的猜想:有 。
【交流讨论】
你认为 同学的猜想一定不正确,理由是 。
【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 。 | _________________。 | 我的猜想成立 |
【反思与总结】判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑 。