题目内容
【题目】某有机化合物含有碳、氢、氧三种元素,其相对分子质量为32。取该有机物6.4克,将其充分燃烧后的产物通入足量的石灰水被完全吸收,经过滤,得到20克沉淀物,滤液的质量比原石灰水减少了4克。
求:(1)原6.4克有机物中所含氧元素的质量为多少?
(2)通过计算确定该有机物的化学式。
【答案】(1)3.2g (2)CH4O
【解析】根据燃烧后的产物通入足量的石灰水被完全吸收,经过滤,得到20克沉淀物可计算出燃烧后生成的CO2的质量,也就可知其中碳元素的质量,即为原有机物中所含碳元素的质量。因为有机物燃烧产生CO2和水,进入石灰水时生成CaCO3沉淀,所以滤液的质量比原石灰水减少的质量即为m(CaCO3沉淀)-m(有机物燃烧生成的水)— m(有机物燃烧生成的CO2),由此可计算出m(有机物燃烧生成的水),也就可知其中氢元素的质量,即为原有机物中所含氢元素的质量。最后根据有机物的质量可求出其中所含氧元素的质量,再确定出其化学式。
解:设燃烧生成的二氧化碳质量为x,则根据化学方程式有:
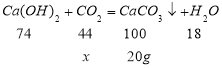
因为反应的二氧化碳的质量x= 44×20/100= 8.8 g
因为该有机物燃烧生成水和二氧化碳,二氧化碳会与石灰水反应,而水并不参与反应,而是被石灰水溶液吸收。所以,反应后滤液减重的质量=离开溶液的物质的质量-进入溶液的物质的质量=反应生成的碳酸钙的质量-有机物燃烧生成的水的质量-有机物燃烧生成的二氧化碳的质量,即:
20g-8.8g-有机物燃烧生成的水的质量=4g
所以有机物燃烧生成的水的质量=7.2 g
所以有机物中碳元素的质量=8.8 g×12/44=2.4g,氢元素的质量=7.2g×2/18=0.8g
所以有机物中氧元素的质量=6.4g-2.4g-0.8g=3.2g
所以碳、氢、氧元素的原子个数比=(1.2/12):(0.4/1):(1.6/16)=1:4:1
所以当该有机物的化学式为CH4O时,其相对分子质量恰为32,符合题目要求,所以该有机物的化学式为CH4O

 阅读快车系列答案
阅读快车系列答案