题目内容
【题目】硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。工业上用废铁屑和含硫酸的废液来制取硫酸亚铁,变废为宝。现用5.6t铁屑与l00t废液恰好完全反应(已知铁屑只和废液中的硫酸反应),请你计算:
(1)可生成硫酸亚铁的质量
(2)所用废液中硫酸的溶质质量分数
【答案】(1)15.2t (2)9.8%
【解析】
(1)根据题意,5.6t铁完全参加反应,是已知量,硫酸亚铁是未知量,它们是相关量。设生成硫酸亚铁的质量为x
Fe + H2SO4 = FeSO4 + H 2↑
56 152
5.6t x
![]() =
=![]() 解得x=15.2 t
解得x=15.2 t
(2)设所用废液中硫酸的质量为y
Fe + H2SO4 = FeSO4 + H 2↑
56 98
5.6t y
![]() =
=![]()
解得 y= 9.8t
废液中硫酸的质量分数为:![]() ×100%=9.8%
×100%=9.8%

【题目】醋的主要成分是醋酸,其化学式为CH3COOH。醋不仅是调味品,而且有较强的灭菌、抑毒的作用。小明为判断家中的9°米醋含酸量是否合格,取l00mL米醋(见标签)于锥形瓶中,然后再向锥形瓶中逐渐加入一定溶质质量分数的碳酸氢钠溶液,反应过程中,当加入碳酸氢钠溶液的质量至以下数值时,对充分反应后锥形瓶中剩余物质的质量进行了记录,测得的部分数据如下,请根据有关信息回答问题:(提示:化学方程式为CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑)
加入碳酸氢钠溶液质量(g) | 25 | 50 | 100 | 155 | 175 |
锥形瓶内剩余物质质量(g) | 123.9 | 147.8 | 195.6 | 248.4 | m |
(l)醋酸中碳、氢、氧三种元素的质量比为_________。
(2)l00mL米醋与足量碳酸氢钠溶液反应产生的二氧化碳质量为_____g,表中m 的数值为____。
(3)请通过计算判断该产品含酸量是否合格?(写出计算过程)

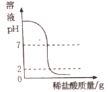
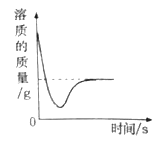
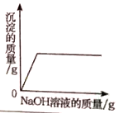
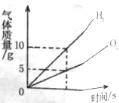
【题目】下列四个图像中,能正确反映对应变化关系的是
|
|
|
|
A.向一定量的氢氧化钠溶液中逐滴加入pH =2的稀盐酸至过量 | B.某温度时,向一定量的饱和石灰水中加入少量生石灰 | C.向盐酸和氯化镁的混合溶液中滴加氢氧化钠溶液 | D.将水通电一段时间 |