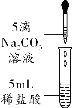题目内容
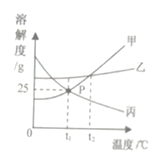
【题目】如图是甲、乙、丙三种物质的溶解度曲线。下列叙述正确的是( )
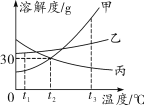
A.将t3℃时的甲、乙两物质的饱和溶液降温到t1℃,析出晶体质量甲>乙
B.t1℃时,将15 g乙物质加入到50 g水中可以得到65 g溶液
C.t2℃时,100 g丙的饱和溶液中有30 g丙
D.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
【答案】B
【解析】
没有指明甲、乙两物质饱和溶液的质量,因此无法比较析出晶体的质量,A错误; t1℃时乙物质的溶解度大于30 g,即50 g水中最多能溶解的乙物质质量大于15 g,所以将15 g乙物质加入到50 g水中形成的是65 g不饱和溶液,B正确;t2℃时,100 g水中能溶解30 g丙物质得到130 g丙的饱和溶液,所以100 g丙的饱和溶液中丙物质的质量小于30 g,C错误;分别将三种物质的饱和溶液从t3℃降温至t2℃时,甲和乙仍为饱和溶液,比较该温度下的溶解度可确定降温后溶液溶质质量分数乙>甲,而丙的溶解度随温度的降低而增大,因此在t2℃时丙溶液的溶质质量分数和t3℃时一样,故所得溶液溶质质量分数的大小关系为乙>甲>丙,D错误。

【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
查阅资料
a.固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。
b.氯化钙、氯化溶液均呈中性。
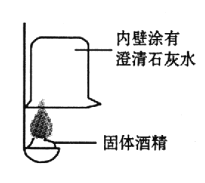
(提出问题)
①酒精中是否含有碳元素?
②固体酒精中的氢氧化钠是否变质?
(实验探究)
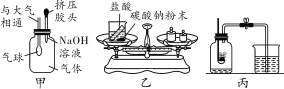
①按右图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有碳元素的结论,理由是_______________。
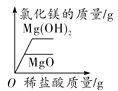
②取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,请用化学方程式表示该沉淀是如何形成的:_______________由此说明氢氧化钠已变质。
③为进一步确定氢氧化钠的变质程度,分组进行探究。
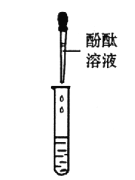
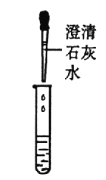
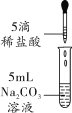
甲组同学取烧杯上层清液于两支试管中,按下图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生______________ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是_______________
他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是_____________
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
【题目】为测定某工厂废液中氢氧化钠的质量分数,分别取废液20g,向其中加入不同质量的硫酸铜溶液(假设废液中其它成份均不与硫酸铜溶液反应),实验数据见表。请计算:
氢氧化钠 溶液质量/g | 硫酸铜溶液质量/g | 生成沉淀 质量/g | |
第一组 | 20 | 50 | 4.9 |
第二组 | 20 | 100 | 9.8 |
第三组 | 20 | 150 | 9.8 |
(1)当氢氧化钠溶液恰好完全反应时生成沉淀的质量为_____g。
(2)该废液中氢氧化钠的质量分数_____。