题目内容
【题目】氢氧化钠和氢氧化钙是两种常见的碱。甲同学将两种碱的溶液分别装入试管A、B,并进行了如下图所示的二组实验。
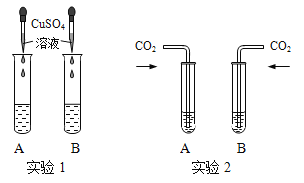
①实验1中,若B中是NaOH溶液,滴加硫酸铜溶液静置后得到蓝色不溶物和无色清液,则清液中溶质的成分是 (13) (用化学式表示)。
②实验2中,甲同学向两支试管中分别通入适量的二氧化碳,A(氢氧化钙溶液)中有白色沉淀生成,发生反应的化学方程式为 (14) ,B(氢氧化钠溶液)中无明显现象。
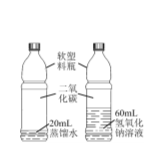 ③为了探究实验2中二氧化碳是否与氢氧化钠反应,甲同学又设计了如下对比实验:
③为了探究实验2中二氧化碳是否与氢氧化钠反应,甲同学又设计了如下对比实验:
乙同学认为该实验设计不符合对比实验的基本 原则,理由是 (15) 。 |
④为了探究实验2中B中溶质的成分,丙同学进行了如下探究:
【提出猜想】猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
【实验探究】
实 验 操 作 | 实验现象 | 结 论 |
I.取B中少量溶液于试管中,加入足量澄清石灰水。 II.静置后,取上层清液,向其中加几滴酚酞试液。 | (16) | 猜想3成立 |
【反思与评价】
老师评价丙同学得出的结论不正确,原因是 (17) ;
为了使“猜想3成立”,丙同学对上述“实验探究”进行了改动,他的做法是 (18) 。
【答案】(13)一定有Na2SO4、可能有NaOH(Na2SO4或、Na2SO4、NaOH)(14)Ca(OH)2+CO2→CaCO3↓+H2O(15)变量不唯一(或实验中可变因素有俩个)④(16)产生白色沉淀、溶液呈红色(17)操作I中碳酸钠与氢氧化钠反应生成了NaOH,会对判断该溶质中是否含有NaOH造成干扰(或猜想2也会产生相同的现象)(18)将操作I中的澄清石灰水改为氯化钡(或氯化钙、硝酸钙、硝酸钡)溶液
【解析】
试题分析:滴加硫酸铜溶液静置后得到蓝色不溶物和无色清液,说明氢氧化钠和硫酸铜反应生成了蓝色沉淀氢氧化铜和硫酸钠,且硫酸铜已反应完全,所以溶质中一定有硫酸钠,可能含有氢氧化钠,用化学式表示为一定有Na2SO4、可能有NaOH或(Na2SO4或、Na2SO4、NaOH)A中氢氧化钙溶液与二氧化碳反应生成白色碳酸钙沉淀和水,化学方程式为Ca(OH)2+CO2→CaCO3↓+H2O验证二氧化碳是否与氢氧化钠,要使用控制变量法,图中采用20 ml蒸馏水和60 ml氢氧化钠溶液,有俩个可变因素,变量不唯一,所以实验设计不符合对比实验原则 ④若猜想3成立,即溶质中既有氢氧化钠又有碳酸钠,碳酸钠会和澄清石灰水产生白色沉淀,氢氧化钠会使酚酞试液变红,所以实验现象为,产生白色沉淀,溶液呈红色,老师评价丙同学结论不正确,原因是操作I中碳酸钠与氢氧化钙反应也会生成NaOH,会对判断该溶质中是否含有NaOH造成干扰,或猜想2也会产生相同现象,合理即可,若要使猜想3成立,应将操作I中的澄清石灰水改为氯化钡或氯化钙,硝酸钙,硝酸钡即可,不会影判断

【题目】深冷法的原理是先将空气液化,再利用氮气和氧气沸点的差异进行分离。
已知:常压下,氧气的沸点是-183℃,氮气的沸点是-196℃。
(1)分离时,氮气和氧气的状态是 (填序号)。
A | B | C | D | |
氧气 | 液态 | 液态 | 气态 | 气态 |
氮气 | 液态 | 气态 | 液态 | 气态 |
(2)制取得到的氧气可以用于 。

