��Ŀ����
����Ŀ��̼����������ķ�Ӧ�Ƿ��������еģ���һ����Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+HCl�TNaCl+NaHCO3��Ϊ��֤�÷�Ӧ���������У���ͼ��ʾ����ʵ�飨װ�����������ã���
�������ע����1��Сҩƿ�о���ע��һ������ϡ���ᣬ��ע�����ʎ��ϸ��������Һ�������ߣ��Qע����2��ƿ�л�����ȡ���壬����ʯ��ˮ�����ǣ�
�����
��1�����䲽����ʵ�������Ԥ������
��2��˵��ϸ��������ʵ���е����ã�
��3��ʵ���Сҩƿ��עʱ��1��ע����2�е������������ε���һ���ྻ���ձ��У�ֻ�õ���ɫ��Һ�������еμӷ�̪��Һ����ɫ��д����Һ�����ʳɷִ��ڵļ����������̪ʡ�Բ�д����

���𰸡��Ȼ��ơ��Ȼ��ƣ��Ȼ��ơ��Ȼ��ơ��Ȼ��⣮
����������1����Ϊ������������̼���Ʒ�Ӧ����̼�����ƣ��������������̼�����ʯ��ˮ�����Ա仯�����Լ�����ϡ���ᣬϡ������̼�����Ʒ�Ӧ����������̼��������̼�ܹ�ʹ�����ʯ��ˮ����ǣ��ʴ�Ϊ����ע����1��Сҩƿ�м���ע��ϡ���ᣬ���϶����ݲ�����ϸ��������Һ���������ߣ���ע����2��ƿ�л�����ȡ���壬����ʯ��ˮ����ǣ�
��2�����ڷ�Ӧ���������Ķ�����̼���ܻ�����������ѹ�����ƿ��������ϸ�����������������ƿ�ڵ������Ѳ���Һ��ѹ�벣�����ڣ��Ӷ���������ã�Ҳ����ͨ��Һ����������˵������������ɣ��ʴ�Ϊ��ϸ�����ܵ���Сҩƿ�ڵ���ѹ����ֹƿ����ѹ����ʱƿ����������ʾСҩƿ�ڡ����ѹǿ������ж�ƿ���Ƿ����������ɣ�
��3����Ϊ������̼���Ʒ�Ӧ�����Ȼ��ƺ�ˮ��������̼��ʵ���Сҩƿ��עʱ��1��ע����2�е������������ε���һ���ྻ���ձ��У�������̼���������Ʒ�Ӧ������̼��Ƴ�������ֻ�õ���ɫ��Һ��˵��̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼�������еμӷ�̪��Һ����ɫ��˵��û�м������ʵĴ��ڣ���������������������Ĺ������ʴ�Ϊ���Ȼ��ơ��Ȼ��ƣ��Ȼ��ơ��Ȼ��ơ��Ȼ��⣮

 ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�����Ŀ���������еĻ�ѧʵ���������������ȡ���ռ�һƿ������̼���Ŀ�����

��1��ָ����������������� ��
��2��ʵ������ȡ������̼ѡ�õķ���װ��Ϊ ������ţ�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����ѧ��ȤС���ͬѧ�Է�Ӧ����Һ�����ʵijɷֽ��н�һ��̽����
��������⡿��Һ�е����ʺ�����Щ����
����������衿����������Һ�е�����ֻ��CaCl2��
����������Һ�е������� ��
������ʵ�顿��ȤС���ͬѧȡ��Һ����������ʵ�飬����������һ���������ʵ�鱨�档
ʵ����� | ʵ������ | ʵ����� |
ȡ������Ӧ��ķ�Һ���Թ��У������м���Na2CO3��Һ������ | ֻ��___________________________ | ��������ȷ |
��_____________________________ ��_____________________________ | ��������ȷ |
�����������ȷ���йط�Ӧ�Ļ�ѧ����ʽΪ�� ��
����˼��չ�������������ȷ��Ҫ�Ƿ�Һ��ֻ����CaCl2����ȷ�Ĵ��������Ǽ�������� ��
����Ŀ���������ƺ��������������ֳ����ļ��ͬѧ�����ּ����Һ�ֱ�װ���Թ�A��B��������������ͼ��ʾ�Ķ���ʵ�顣
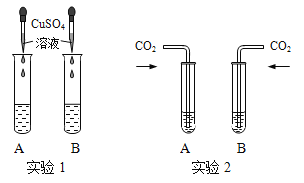
��ʵ��1�У���B����NaOH��Һ���μ�����ͭ��Һ���ú�õ���ɫ���������ɫ��Һ������Һ�����ʵijɷ��� ��13�� ���û�ѧʽ��ʾ����
��ʵ��2�У���ͬѧ����֧�Թ��зֱ�ͨ�������Ķ�����̼��A������������Һ�����а�ɫ�������ɣ�������Ӧ�Ļ�ѧ����ʽΪ ��14�� ��B������������Һ��������������
 ��Ϊ��̽��ʵ��2�ж�����̼�Ƿ����������Ʒ�Ӧ����ͬѧ����������¶Ա�ʵ�飺
��Ϊ��̽��ʵ��2�ж�����̼�Ƿ����������Ʒ�Ӧ����ͬѧ����������¶Ա�ʵ�飺
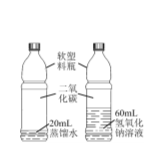
��ͬѧ��Ϊ��ʵ����Ʋ����϶Ա�ʵ��Ļ��� ԭ�������� ��15�� �� |
��Ϊ��̽��ʵ��2��B�����ʵijɷ֣���ͬѧ����������̽����
��������롿����1������ֻ����������
����2������ֻ��̼����
����3���������������ƺ�̼����
��ʵ��̽����
ʵ �� �� �� | ʵ������ | �� �� |
I��ȡB��������Һ���Թ��У�������������ʯ��ˮ�� II�����ú�ȡ�ϲ���Һ�������мӼ��η�̪��Һ�� | ��16�� | ����3���� |
����˼�����ۡ�
��ʦ���۱�ͬѧ�ó��Ľ��۲���ȷ��ԭ���� ��17�� ��
Ϊ��ʹ������3����������ͬѧ��������ʵ��̽���������˸Ķ������������� ��18�� ��


