题目内容
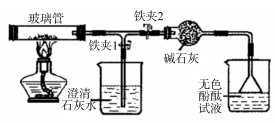
【题目】某研究小组利用如图所示装置研究碳的氧化物的性质(固定装置略)。已知碳酸镁加热发生类似碳酸钙的分解反应。
![]()

(1)装置A中发生反应的化学方程式:MgCO3![]() +CO2↑
+CO2↑
(2)装置C的作用: , CaO的作用: 。
(3)装置B中发生的反应: (用化学方程式表示)。
(4)图中装置E的作用: 。
(5)本实验中体现了一氧化碳的化学性质是: 。
【答案】(1)MgO(2)吸收二氧化碳;干燥二氧化碳(3)C + CO2 ![]() 2CO(4)防止F中的溶液倒吸入D中,将试管炸裂(5)还原性
2CO(4)防止F中的溶液倒吸入D中,将试管炸裂(5)还原性
【解析】
试题分析:装置A中发生反应的化学方程式:MgCO3![]() MgO+CO2↑;装置C的作用:吸收二氧化碳,CaO的作用:干燥二氧化碳。装置B中发生的反应:C+CO2
MgO+CO2↑;装置C的作用:吸收二氧化碳,CaO的作用:干燥二氧化碳。装置B中发生的反应:C+CO2![]() 2CO。图中装置E的作用:)防止F中的溶液倒吸入D中,将试管炸裂。实验中体现了一氧化碳的化学性质是:还原性。
2CO。图中装置E的作用:)防止F中的溶液倒吸入D中,将试管炸裂。实验中体现了一氧化碳的化学性质是:还原性。

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】今年我市的化学实验操作考试有“制取并收集一瓶二氧化碳”的考题。

(1)指出标号①的仪器名称 。
(2)实验室制取二氧化碳选用的发生装置为 (填序号),反应的化学方程式为 。
(3)化学兴趣小组的同学对反应后溶液中溶质的成分进行进一步探究。
【提出问题】废液中的溶质含有哪些物质
【猜想与假设】猜想Ⅰ:废液中的溶质只有CaCl2;
猜想Ⅱ:废液中的溶质有 。
【进行实验】兴趣小组的同学取废液进行了以下实验,请你与他们一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量反应后的废液于试管中,向其中加入Na2CO3溶液至过量 | 只有___________________________ | 猜想Ⅰ正确 |
先_____________________________ 后_____________________________ | 猜想Ⅱ正确 |
如果猜想Ⅰ正确,有关反应的化学方程式为: ;
【反思拓展】如果猜想Ⅱ正确,要是废液中只含有CaCl2,正确的处理方法是加入过量的 。
【题目】氢氧化钠和氢氧化钙是两种常见的碱。甲同学将两种碱的溶液分别装入试管A、B,并进行了如下图所示的二组实验。
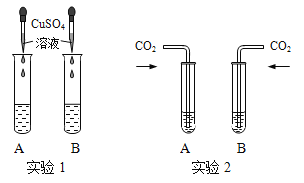
①实验1中,若B中是NaOH溶液,滴加硫酸铜溶液静置后得到蓝色不溶物和无色清液,则清液中溶质的成分是 (13) (用化学式表示)。
②实验2中,甲同学向两支试管中分别通入适量的二氧化碳,A(氢氧化钙溶液)中有白色沉淀生成,发生反应的化学方程式为 (14) ,B(氢氧化钠溶液)中无明显现象。
 ③为了探究实验2中二氧化碳是否与氢氧化钠反应,甲同学又设计了如下对比实验:
③为了探究实验2中二氧化碳是否与氢氧化钠反应,甲同学又设计了如下对比实验:
乙同学认为该实验设计不符合对比实验的基本 原则,理由是 (15) 。 |
④为了探究实验2中B中溶质的成分,丙同学进行了如下探究:
【提出猜想】猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
【实验探究】
实 验 操 作 | 实验现象 | 结 论 |
I.取B中少量溶液于试管中,加入足量澄清石灰水。 II.静置后,取上层清液,向其中加几滴酚酞试液。 | (16) | 猜想3成立 |
【反思与评价】
老师评价丙同学得出的结论不正确,原因是 (17) ;
为了使“猜想3成立”,丙同学对上述“实验探究”进行了改动,他的做法是 (18) 。