题目内容
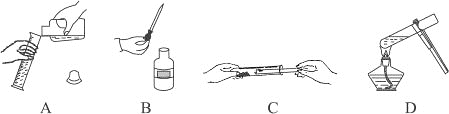
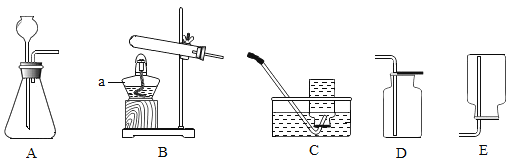
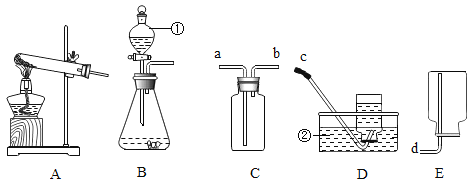
【题目】下图所示的实验操作正确的是( )
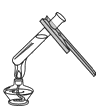
A.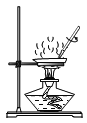 蒸发食盐水B.
蒸发食盐水B.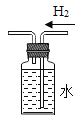 收集氢气
收集氢气
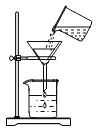
C.![]() 配置氯化钠溶液D.
配置氯化钠溶液D.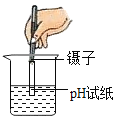 测定溶液的pH
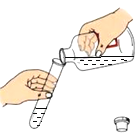
测定溶液的pH
【答案】A
【解析】
A、蒸发食盐水时,将适量的食盐水加到蒸发皿中,将蒸发皿置于铁架台的铁圈上,用酒精灯直接加热,边加热边用玻璃棒搅拌,防止液体受热不匀发生迸溅,选项正确;
B、通过多功能瓶采用排水法收集氢气时,由于氢气不溶于水且氢气的密度小于水的密度,氢气应从短管进入瓶中,才能使水顺利排除瓶外,实现收集氢气的目的,选项错误;
C、量筒仅用于量取一定体积的液体,不能用作溶解的容器,溶解物质的容器应选择烧杯,选项错误;
D、用pH试纸测溶液的pH时,应用玻璃棒将待测液滴到pH试纸上,不能将pH试纸浸入待测溶液中,否则pH试纸上的物质会污染溶液,选项错误,故选A。

【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:
【实验探究一】:
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | 猜想1正确 |
【继续探究】:钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】:
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入 |
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 。
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为 。
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 碱性氧化物(填“是”或“不是”)。