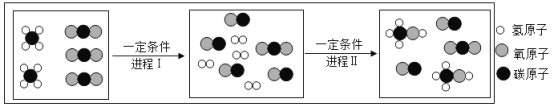
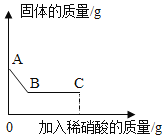
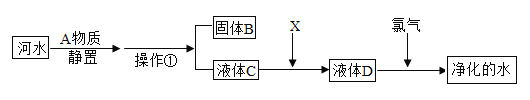
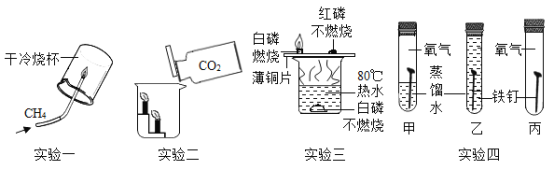
题目内容
【题目】废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对锡的绿色回收,设计如下工艺流程:
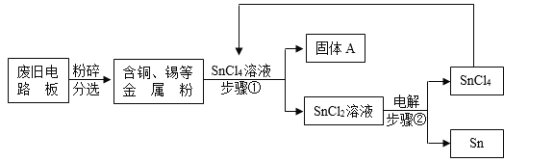
已知:Sn+SnCl4=2SnCl2
(1)固体A中一定含有的金属元素是_____。
(2)写出步骤②发生反应的化学方程式_____。
(3)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是_____。(回答一点)
【答案】铜  减轻了环境污染,回收了金属资源等
减轻了环境污染,回收了金属资源等
【解析】
(1)铜的金属活动性比锡的弱,因此加入铜不能与SnCl4反应,所以固体A中一定含有的金属元素是Cu;
(2)步骤②中SnCl2通电分解生成SnCl4和Sn,发生反应的化学方程式为2SnCl2![]() SnCl4+Sn;
SnCl4+Sn;
(3)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是减轻了环境污染,回收了金属资源等;
故填:(1)Cu;(2)2SnCl2 ![]() SnCl4+Sn;(3)减轻了环境污染,回收了金属资源等。
SnCl4+Sn;(3)减轻了环境污染,回收了金属资源等。

 名校课堂系列答案
名校课堂系列答案【题目】某兴趣小组对酸碱中和反应进行了如下探究。请回答相关问题。
I.探究酸和碱能否发生反应
方案l:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由______色变成无色。甲同学得出结论:酸和碱能发生反应。请写出稀硫酸和氢氧化钠溶液反应的化学方程式________。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液;大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须________(填“小于”或“小于或等于”)7,才能证明酸和碱能发生反应。
II.探究酸和碱反应后溶液中溶质的成分
丙同学对探究I中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(提出猜想)(l)Na2SO4;(2)______。
(设计实验)
实验操作 | 实验现象 | 实验结论 | |
方案I | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有_______产生 | 猜想(2)成立 |
方案II | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现______。 |
(实验反思)为了验证猜想(2)成立,你认为还可以选择的药品是____(填字母序号)。
A BaCl2溶液 B Cu C Fe2O3 D Cu(OH)2
【题目】一定条件下密闭容器内发生某反应,反应过程中各物质的质量变化见下表。
物质 | 甲 | 乙 | 丙 | 丁 |
反应前 | 46g | 100g | 2g | 0 |
反应中 | 23g | 52g | 46g | m1 |
反应后 | m2 | 4g | m3 | m4 |
其中未知数据错误的是
A.m1为29gB.m2为0gC.m3为90gD.m4为54g