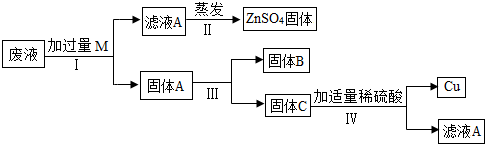
题目内容
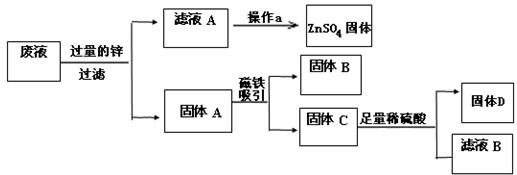
16、某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:
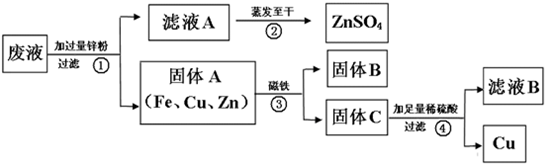
请回答:
(1)写出一个步骤①中反应的化学方程式:
(2)由步骤①可知,在固体A中最活泼的金属是
(3)步骤①加入过量锌粉的目的是
(4)步骤④中反应的化学方程式为

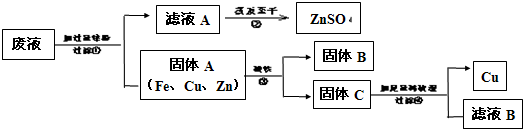
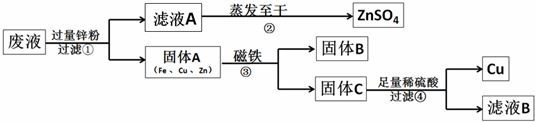
请回答:
(1)写出一个步骤①中反应的化学方程式:
Zn+FeSO4═ZnSO4+Fe(或Zn+CuSO4═ZnSO4+Cu)
.(2)由步骤①可知,在固体A中最活泼的金属是
Zn
,若要证明另两种金属的活动性顺序,可以使用的药品是铁与硫酸铜溶液
.(3)步骤①加入过量锌粉的目的是
将铁与铜都置换出来
.(4)步骤④中反应的化学方程式为
Zn+H2SO4═ZnSO4+H2↑
.分析:(1)根据废水的成分和金属的活泼性来分析发生的化学反应,然后书写化学反应方程式;
(2)根据活泼金属能置换较不活泼金属来分析金属的活泼性强弱;
(3)根据实验是回收金属及固体A可分析加入过量锌粉的目的;
(4)根据固体C的成分来分析发生的化学反应,然后书写化学反应方程式.
(2)根据活泼金属能置换较不活泼金属来分析金属的活泼性强弱;
(3)根据实验是回收金属及固体A可分析加入过量锌粉的目的;
(4)根据固体C的成分来分析发生的化学反应,然后书写化学反应方程式.
解答:解:(1)因金属的活泼性Zn>Fe>Cu,由废水中含有CuSO4,ZnSO4、FeSO4,则加入锌粉能发生锌与硫酸亚铁、锌与硫酸铜的反应,其反应分别为Zn+FeSO4═ZnSO4+Fe、Zn+CuSO4═ZnSO4+Cu,故答案为:Zn+FeSO4═ZnSO4+Fe(或Zn+CuSO4═ZnSO4+Cu);
(2)因锌能与硫酸亚铁、与硫酸铜都能发生置换反应,则锌的活泼性最强,若证明铁和铜的活泼性,可选用铁与硫酸铜,若发生反应能置换出红色的物质,则说明铁的活泼性比铜的强,反之,铁比铜的活泼性弱,故答案为:Zn;铁与硫酸铜溶液(或铜与硫酸亚铁溶液 或其它合理答案);
(3)因最后回收铁和铜,则固体A的成分有铁、铜、锌,则锌粉过量的目的是将金属铁和铜全部置换出来,故答案为:将铁与铜都置换出来;
(4)因固体A经磁铁将铁分离开,固体C中含有锌与铜,加足量稀硫酸时,铜并不反应经过滤可得到,而锌与稀硫酸发生化学反应,其反应为Zn+H2SO4═ZnSO4+H2↑,故答案为:Zn+H2SO4═ZnSO4+H2↑.
(2)因锌能与硫酸亚铁、与硫酸铜都能发生置换反应,则锌的活泼性最强,若证明铁和铜的活泼性,可选用铁与硫酸铜,若发生反应能置换出红色的物质,则说明铁的活泼性比铜的强,反之,铁比铜的活泼性弱,故答案为:Zn;铁与硫酸铜溶液(或铜与硫酸亚铁溶液 或其它合理答案);
(3)因最后回收铁和铜,则固体A的成分有铁、铜、锌,则锌粉过量的目的是将金属铁和铜全部置换出来,故答案为:将铁与铜都置换出来;
(4)因固体A经磁铁将铁分离开,固体C中含有锌与铜,加足量稀硫酸时,铜并不反应经过滤可得到,而锌与稀硫酸发生化学反应,其反应为Zn+H2SO4═ZnSO4+H2↑,故答案为:Zn+H2SO4═ZnSO4+H2↑.
点评:本题考查金属的回收和废水的利用,学生应明确金属的活泼性来分析发生的化学反应,并应能准确判断每步转化中滤液和固体的成分.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目