题目内容
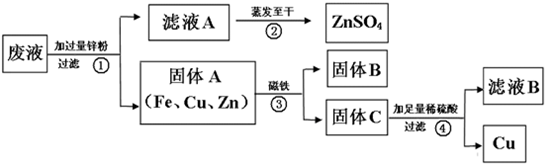
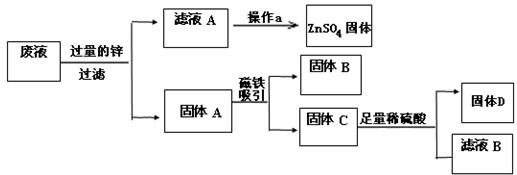
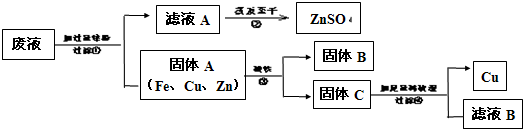
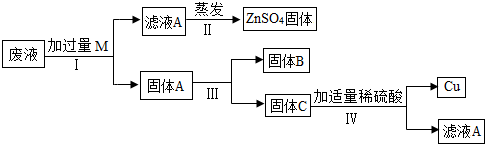
某电镀厂为减少水污染及节约成本,从含有CuSO4,ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下: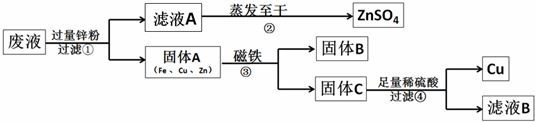
请回答:
(1)滤液A和滤液B含有相同的溶质是
(2)写出步骤①其中一个反应的化学方程式:
(3)步骤①加入的锌粉为什么要过量,请你简要说明理由
(4)固体B的物质是

请回答:
(1)滤液A和滤液B含有相同的溶质是
ZnSO4
ZnSO4
.(2)写出步骤①其中一个反应的化学方程式:
Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe
Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe
.(3)步骤①加入的锌粉为什么要过量,请你简要说明理由
将废液中的FeSO4和CuSO4完全反应掉.
将废液中的FeSO4和CuSO4完全反应掉.
.(4)固体B的物质是
Fe
Fe
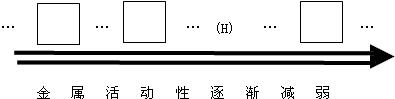
.分析:可以根据物质之间相互作用时能否发生反应及其反应时生成物是什么等方面进行分析、考虑,从而得出正确的结论,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:因为锌比铜和铁活泼,所以能把硫酸铜、硫酸亚铁中的铜、铁置换出来.铁能被磁铁吸引,从而把铁分离出来.锌能和稀硫酸反应生成硫酸锌,铜不能和稀硫酸反应,从而把铜分离出来.硫酸锌溶液经过蒸发得到硫酸锌固体.
(1)滤液A和滤液B含有相同的溶质是硫酸锌.故填:ZnSO4
(2)锌能与硫酸铜反应生成硫酸锌和铜,锌能与硫酸亚铁反应生成硫酸锌和铁,故填:Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe
(3)加入过量锌的原因是将废液中的FeSO4和CuSO4完全反应掉.故填:将废液中的FeSO4和CuSO4完全反应掉.
(4)固体B能被磁铁吸引,故B的物质是铁,故填:Fe.
(1)滤液A和滤液B含有相同的溶质是硫酸锌.故填:ZnSO4
(2)锌能与硫酸铜反应生成硫酸锌和铜,锌能与硫酸亚铁反应生成硫酸锌和铁,故填:Zn+CuSO4=ZnSO4+Cu或Zn+FeSO4=ZnSO4+Fe
(3)加入过量锌的原因是将废液中的FeSO4和CuSO4完全反应掉.故填:将废液中的FeSO4和CuSO4完全反应掉.
(4)固体B能被磁铁吸引,故B的物质是铁,故填:Fe.
点评:本题考查金属的回收和废水的利用,学生应明确金属的活泼性来分析发生的化学反应,并应能准确判断每步转化中滤液和固体的成分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目