题目内容
(2013?朝阳区二模)金属在生产和生活中有广泛的应用.
(1)钢铁可以制成炒锅,主要利用了铁的延展性和
(2)下列关于金属的说法正确的是
A.常温下金属均为固态
B.在铁制品表面刷漆防止铁锈蚀
C.铜是目前世界年产量最高的金属
D.金属与酸反应后溶液质量一定增加
E.铝表面易生成致密的氧化膜,因此铝有良好的抗腐蚀性
(3)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下:
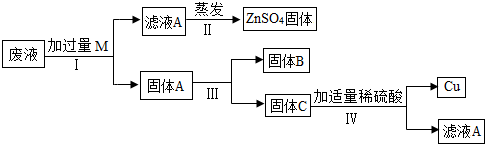
①步骤Ⅰ中加入过量M的目的是
②步骤Ⅲ的操作为
(1)钢铁可以制成炒锅,主要利用了铁的延展性和
导热
导热
性.(2)下列关于金属的说法正确的是
BDE
BDE
.A.常温下金属均为固态
B.在铁制品表面刷漆防止铁锈蚀
C.铜是目前世界年产量最高的金属
D.金属与酸反应后溶液质量一定增加
E.铝表面易生成致密的氧化膜,因此铝有良好的抗腐蚀性
(3)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下:

①步骤Ⅰ中加入过量M的目的是
使溶液中的CuSO4和FeSO4充分反应
使溶液中的CuSO4和FeSO4充分反应
,写出该步骤中反应的化学方程式Zn+CuSO4=Cu+ZnSO4;Zn+FeSO4=Fe+ZnSO4
Zn+CuSO4=Cu+ZnSO4;Zn+FeSO4=Fe+ZnSO4
.②步骤Ⅲ的操作为
用磁铁吸引
用磁铁吸引
.分析:金属具有良好的导热性、导电性、延展性等;在金属活动性顺序中,排在前面的金属能够把排在后面的金属从它的盐溶液中置换出来;书写化学方程式要注意规范性.
解答:解:(1)钢铁具有良好的导热性,可以制作炊具.
故填:导热.
(2)A、常温下,汞是液体.不正确.
B、在铁制品表面刷漆能够使铁与水和氧气隔绝,防止铁锈蚀.正确.
C、铜不是目前世界年产量最高的金属,铁是目前世界年产量最高的金属.不正确.
D、金属与酸反应时,生成盐和氢气,随着反应的进行,溶液质量增加.正确.
E、铝的化学性质比较活泼,能够和氧气反应生成致密的氧化膜,因此铝有良好的抗腐蚀性.正确.
故填:BDE.
(3)①步骤Ⅰ中加入的是过量的锌,目的是使溶液中的CuSO4和FeSO4充分反应;锌与硫酸铜、硫酸亚铁反应的化学方程式分别为:Zn+CuSO4=Cu+ZnSO4、Zn+FeSO4=Fe+ZnSO4.
故填:使溶液中的CuSO4和FeSO4充分反应;Zn+CuSO4=Cu+ZnSO4;Zn+FeSO4=Fe+ZnSO4.
②固体A中含有铜、铁和锌,铁能被磁铁吸引,通过磁铁可以把铁从铜、铁和锌中分离出来.
故填:用磁铁吸引.
故填:导热.
(2)A、常温下,汞是液体.不正确.
B、在铁制品表面刷漆能够使铁与水和氧气隔绝,防止铁锈蚀.正确.
C、铜不是目前世界年产量最高的金属,铁是目前世界年产量最高的金属.不正确.
D、金属与酸反应时,生成盐和氢气,随着反应的进行,溶液质量增加.正确.
E、铝的化学性质比较活泼,能够和氧气反应生成致密的氧化膜,因此铝有良好的抗腐蚀性.正确.
故填:BDE.
(3)①步骤Ⅰ中加入的是过量的锌,目的是使溶液中的CuSO4和FeSO4充分反应;锌与硫酸铜、硫酸亚铁反应的化学方程式分别为:Zn+CuSO4=Cu+ZnSO4、Zn+FeSO4=Fe+ZnSO4.
故填:使溶液中的CuSO4和FeSO4充分反应;Zn+CuSO4=Cu+ZnSO4;Zn+FeSO4=Fe+ZnSO4.
②固体A中含有铜、铁和锌,铁能被磁铁吸引,通过磁铁可以把铁从铜、铁和锌中分离出来.
故填:用磁铁吸引.
点评:本题主要考查物质的性质方面的知识,同时考查了化学方程式的书写,书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目