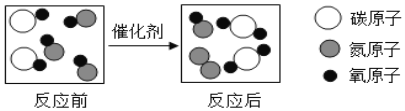
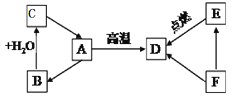
��Ŀ����
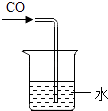
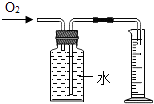
����Ŀ����ͼ��������������ͭ��Ӧ��ʵ��װ�ã���ͼ����ľ̿������ͭ��Ӧ��ʵ��װ�á�
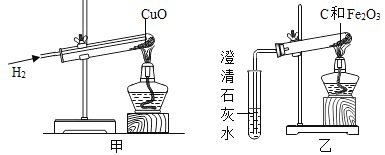
(1)����������ʵ���У�������ľ̿���ֳ���ͬ�Ļ�ѧ���ʣ��û�ѧ������____________��
(2)ʵ�������ȷ��ʵ��ɹ��Ĺؼ�����ʵ���У���Ӧǰ������ͨ�������ȼ�ƾ��ƣ���������______________����ʵ���У���Ҫ�۲쵽�����������Ҫ����װ�øĽ���____________________��
(3)��ͼ����ԭװ������ʵ��۲쵽С�Թ��г���ʯ��ˮ����ǣ����Թ��з�ĩȫ����Ϊ��ɫ����ʦȴָ������ʱ�����ĺ�ɫ����ɷֻ���Ҫ��һ���о���
��������⡿ľ̿������ͭ��Ӧ���ɵĺ�ɫ�����п��ܺ���ʲô���ʣ�
���������ϡ�ľ̿������ͭ��ӦҲ��������������ͭ(Cu2O);������ͭ�Ǻ�ɫ���壬����ϡ���ᷴӦ��Cu2O+H2SO4=Cu+CuSO4+H2O��
�����в��롿ľ̿������ͭ��Ӧ���ɵĺ�ɫ����ɷ֣�
��_________________����ȫ����������ͭ���������ߵĻ���
��ʵ��̽����
���� | ���� | ���� |
ȡ1.8g��ɫ�������Թ��У��μ�����________����ַ�Ӧ | _____________________ | ����ٴ��� |
���ˣ�������ϴ�ӡ�������� | ���ù���������ΧΪ_______ | �������ȷ |
���𰸡� ��ԭ�� ��ը ���ƾ��ƻ��ɾƾ���ƻ��ھƾ��ƵĻ����Ϸ���һֻ�������� ȫ����ͭ ϡ���� ��ɫ���岿���ܽ⣬��Һ���� 0.8g-1.8g
��������(1)������ľ̿���ܰ�����ͭ���ͭ�û�������������ľ̿���ֳ���ͬ�Ļ�ѧ���ʣ��û�ѧ�����ǻ�ԭ����(2)�����ǿ�ȼ�����壬�Ϳ�����ϴﵽһ��Ũ�Ⱦͻᷢ����ը��Ӧǰ������ͨ�������ȼ�ƾ��ƣ���ʵ���У�ľ̿��ԭ����ͭ��Ҫ�ܸߵ��¶ȣ���Ҫ�۲쵽�����������Ҫ����װ�øĽ��ǽ��ƾ��ƻ��ɾƾ���ƻ��ھƾ��ƵĻ����Ϸ���һֻ����������������¶���(3)������ϲ���ԭ��������ȫ����ͭ����ʵ��̽����
���� | ���� | ���� |
ȡ1.8g��ɫ�������Թ��У��μ�����ϡ��������ַ�Ӧ | ��ɫ���岿���ܽ⣬��Һ���� | ����ٴ��� |
���ˣ�������ϴ�ӡ�������� | ���ù���������ΧΪ0.8g-1.8g | �������ȷ |
�⣺�������������ֻ��������ͭ��������ͭ������Ϊ![]() ��
��
Cu2O+H2SO4��ϡ��=Cu+CuSO4+H2O
144 64
1.8g ![]()
![]()
![]() =0.8g�������ù���������0.8gʱ������ʵ�������ɫ���岿���ܽ⣬��Һ������֪�����ù�������Ӧ��С��1.8g��
=0.8g�������ù���������0.8gʱ������ʵ�������ɫ���岿���ܽ⣬��Һ������֪�����ù�������Ӧ��С��1.8g��