题目内容
【题目】(2018云南改编)某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
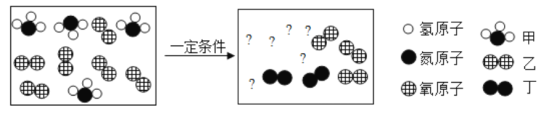
Ⅰ.初步探究:小金同学设计的实验过程及现象如图所示。
(查阅资料)BaCl2溶液显中性。
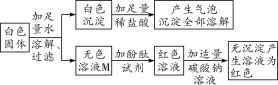
(初步结论)(1)原白色固体中一定有的物质是___,一定没有的物质是_____。
(2)M溶液中的溶质一定有_________,一定没有氯化钡。
(交流讨论)小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液M中有氢氧化钠吗?
(猜想与假设)猜想一:有NaOH猜想二:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 | ___ | 证明溶液M中有碳酸钠并被除尽 |
B.取实验A所得上层清液于试管中,加入______ | ____ | 猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。写出上述步骤A中发生反应的化学方程式_______。
【答案】BaCl2和Na2CO3(或氯化钡和碳酸钠) Na2SO4(或硫酸钠) NaCl(或氯化钠) 产生白色沉淀 无色酚酞溶液(合理即可) 溶液变红(与上一空对应即可) BaCl2+Na2CO3= BaCO3↓+2NaCl
【解析】
【初步结论】探究白色固体的成分时,固体加足量的水,溶解过滤得到白色沉淀和无色溶液M,白色沉淀全部溶于稀盐酸,并产生气泡,说明白色沉淀是碳酸钡而不是硫酸钡,因此原物质中一定含有氯化钡和碳酸钠,一定不含硫酸钠。无色溶液M中加酚酞试剂变红色,说明溶液M显碱性,加适量的碳酸钠溶液无沉淀产生,溶液仍为红色,说明溶液M中一定有反应生成的NaCl,没有氯化钡。【探究与结论】A中向溶液M中滴加氯化钡溶液,结合结论证明溶液M中有碳酸钠并被除尽,可知实验现象为产生白色沉淀;由B中实验结论猜想一正确,即溶液M中含氢氧化钠,要验证溶液中有氢氧化钠,可知向A所得上层清液中加入无色酚酞溶液或可溶性铜盐、镁盐等,根据溶液变红色或有蓝色、白色沉淀产生的现象可确定出溶液中一定含有氢氧化钠,从而得出结论。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案