题目内容
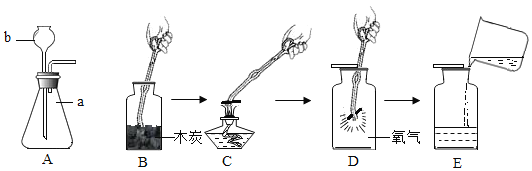
【题目】高纯氧化铁(Fe2O3)又称“引火铁”,可作催化剂,在现代工业上有广泛应用前景。以下是用赤铁矿(含少量 SiO2 等杂质)为原料,制备高纯氧化铁的生产流程示意图。
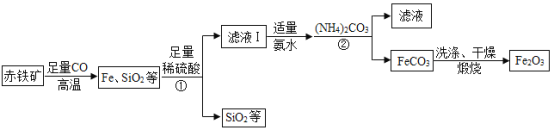
已知:氨水呈碱性(主要成分 NH3·H2O 是一种碱);(NH4)2CO3溶液呈碱性,40℃以上易分解。
(1)写出高温时赤铁矿中的Fe2O3与CO发生反应的化学方程式______________。
(2)①处发生反应的化学方程式为_______________________。
(3)加入(NH4)2CO3后,该反应必须控制的条件是____________;(NH4)2CO3与FeSO4发生复分解反应而生成FeCO3,则②处反应的化学方程式为__________________________。
(4)用蒸馏水洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志是:取最后一次洗涤液,向其中加入适量的BaCl2溶液,无____________(填现象)产生,即为洗涤干净。
【答案】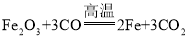
![]() 温度在40℃以下
温度在40℃以下 ![]() 白色沉淀
白色沉淀
【解析】
(1)高温时赤铁矿中的Fe2O3与CO反应生成铁和二氧化碳,该反应的化学方程式为: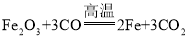 ;
;
(2)①处发生的反应为铁与稀硫酸反应生成硫酸亚铁和氢气,该反应的化学方程式为:![]() ;
;
(3)(NH4)2CO3溶液呈碱性,40℃以上易分解,故加入(NH4)2CO3后,该反应必须控制的条件是:温度在40℃以下;
(NH4)2CO3与FeSO4发生复分解反应而生成FeCO3,复分解反应为两种化合物互相交换成分生成另外两种化合物,故另一种产物是(NH4)2SO4,故②处反应的化学方程式为:![]() ;
;
(4)氯化钡能与硫酸铵反应生成硫酸钡沉淀,故取最后一次洗涤液,向其中加入适量的BaCl2溶液,无白色沉淀产生,即为洗涤干净。

【题目】有一份铜锌合金粉末样品(设只含铜、锌),为认识其组成等,某学习小组进行了以下探究,请参与并完成有关计算:
(1)取样品20g,和足量稀硫酸充分混合,待反应完全后过滤,将滤渣洗涤,干燥后称得其质量为13.5g。该样品中铜的质量分数为______。
(2)再取三份不同质量的样品,分别加入到三份100g相同浓度的硫酸溶液中,充分反应后,测得的数据如下表:
实验序号 | ① | ② | ③ |
样品的质量/g | 10 | 20 | 30 |
生成气体的质量/g | 0.1 | 0.2 | 0.25 |
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。_______