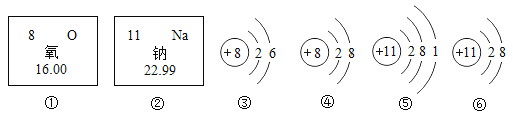
题目内容
【题目】取NaOH和NaCl的混合物3.63克放入烧杯中,加水溶解配制成70克溶液。向该溶液滴加溶质质量分数为7.3%的稀盐酸,测得溶液pH与滴入稀盐酸的质量关系如图所示。
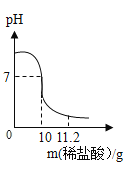
(1)当滴入稀盐酸的质量为11.2克时,溶液的pH_____7(填“>”、“<”或“=”);此时溶液中的溶质是_____(填化学式)。
(2)当pH=7时,计算该溶液中溶质的质量分数。(写出计算过程)_____。
【答案】< NaCl、HCl 5%
【解析】
(1)氢氧化钠和盐酸反应生成中性的氯化钠和水,所以当滴入稀盐酸的质量为11.2g时,溶液pH<7,溶液呈酸性,此时盐酸过量,所含的溶质为氯化钠和氯化氢;
(2)设:反应生成NaCl的质量为x,氢氧化钠的质量为y。
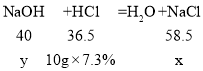
![]() x=1.17g;
x=1.17g;
![]() y=0.8g;
y=0.8g;
所得溶液中溶质的质量=(3.63g﹣0.8g)+1.17g=4g;
所得溶液的质量=70g+10g=80g;
所得溶液中溶质的质量分数=![]() 。
。
答:所得溶液中溶质的质量分数为5%。

 阅读快车系列答案
阅读快车系列答案【题目】某学校开展了如下“溶液酸碱性的检验”的实验活动.
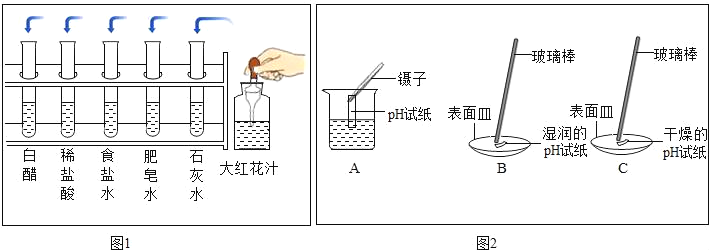
(1)把自制的大红花汁按图1所示分别滴加到试管中,观察到的现象如表所示:
试剂 | 白醋 | 稀盐酸 | 食盐水 | 肥皂水 | 石灰水 |
加入红花汁后的颜色 | 橙色 | 橙色 | 粉红色 | 绿色 | 绿色 |
①图1大红花汁_____(填“可以”或“不可以”)作酸碱指示剂.
②据上表推测,大红花汁遇到稀硫酸溶液显示的颜色是_____.
③取少量厨房清洁剂放入试管中,加入大红花汁,发现溶液变为绿色,得出厨房清洁剂显_____性.
(2)用pH试纸测得碳酸饮料的pH_____(填“>”、“<”、“=”)7.
(3)图2是三位同学分别测定肥皂水酸碱性的操作示意图,其中正确的是_____(填“A”、“B”、“C”,下同),可能导致肥皂水pH数值发生改变的错误操作是_____.