题目内容
【题目】欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
【答案】(1)Cu﹣Zn
(2)合金中铜的质量分数为60%
【解析】
试题分析:(1)在铜银合金中,两种金属的活动性均在氢的后面。所以都不能和酸发生反应。因此无法测出其中的成分。在铜锌合金中,铜不与酸反应,锌能与酸反应生成氢气。所以可通过测量生成氢气的质量(或固体与酸充分反应后的减少的质量),得知金属锌的质量。进一步求出铜的质量分数。 即现有条件下能测出铜锌合金中铜的质量分数。
(2)已知量:氢气的质量为0.4g;未知量:铜在合金中的质量分数。
解题思路:可根据锌与硫酸反应的化学方程式,利用锌和氢气在反应中的质量关系求解出合金中含锌的质量。进一步求出铜的质量及其中合金中的质量分数。具体解题过程如下:
【解】设合金中Zn的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 2
![]() 4g
4g
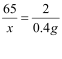
x = 13 g
合金中铜的质量= 32.5g – 13g = 19.5g
合金中铜的质量分数为:![]() 60%
60%
答:合金中铜的质量分数为60%。(其它合理解法均可)

【题目】“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
甲 | 乙 | 丙 | |
烧杯+稀盐酸质量 | 139g | 129g | 129g |
加入黄铜样品质量 | 20g | 24g | 20g |
充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 .
(2)计算黄铜样品中锌的质量分数.