题目内容
【题目】(7分)如图为用镀锌铁片制成的日常用品。镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀锌产品广泛用于建筑、家电、车船、容器制造业、机电业等,几乎涉及衣食住行各个领域。为测定铁片镀锌层的厚度实验过程如下。

【实验步骤】
(1)剪取一片镀锌铁片,量得长度=2.0 cm,宽度=l.9 cm。
(2)用电子天平称量质量0.857g。
(3)实验中需要溶质质量分数为10%的稀盐酸200 mL(密度=1.05g/mL),需要量取溶质质量分数为37%的浓盐酸(密度=1.18g/mL)____(保留至小数点后1位)mL,然后稀释。
(4)将镀锌铁片放入溶质质量分数为10%盐酸中。当观察到_______,可以判断镀锌层恰好反应。
(5)将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g。
【计算结果】
(1)铁片镀锌层的质量有____g。
(2)已知锌的密度7.1g/cm3,计算出铁片镀锌层厚度mm。
【实验反思】
实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间____(填“偏长”或“偏短”)。
【实验改进】
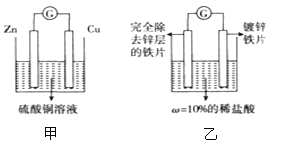
资料卡片:如图甲所示,两种金属活动性不同的金属放入酸、碱、盐溶液中,会有电子的流动,从而产生电流。
将上述实验改进成如图乙的装置,当观察到____,此时锌层恰好反应。
【答案】【实验步骤】48.1 (1分) 气泡产生的速率突然减慢 (1分)
【计算结果】(1)0.02g(1分) (2)0.37(2分)
【实验反思】偏长(1分)
【实验改进】电流计指针指向“0” (1分)
【解析】
试题分析:【实验步骤】(3)溶液稀释前后,溶质质量不变:
设需取用37%(ρ=1.18g/cm3)的盐酸的体积为x
10%×200mL×1.05g/mL=37%×1.18g/mL×x
x≈48.1mL;
(4)当锌镀层完全反应后就是铁与盐酸反应,由于锌和铁的活泼性不同,反应速率就不同,可观察到产生气泡的速率明显下降;当反应速率明显降低时,可说明镀锌铁皮表面锌恰好反应;
【计算结果】(1)铁片镀锌层的质量=原镀锌铁片的质量-烘干后铁片的质量:0.857g-0.837g=0.02g;
(2)根据题意可知锌的质量为0.02g,锌的密度为7.1g/cm3;锌层厚度=![]() =
=![]() ≈0.037cm=0.37mm;
≈0.037cm=0.37mm;
【实验反思】铁也会与盐酸反应产生氢气,因此很难判断什么时候锌正好反应掉而铁没有反应;当镀锌铁片浸泡在盐酸中时间过长时,锌反应完毕,铁就会与盐酸反应,所以经过称量得到锌的质量偏大;
【实验改进】用铁、锌作电极,稀盐酸作电解质溶液设计原电池,锌的金属性比铁强,会有电子的流动,从而产生电流.锌作负极,铁作正极,电子从负极沿导线流向正极.当反应停止时,电子停止流动,电流为0,锌恰好反应.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案