题目内容
【题目】请按照要求完成下列金属性质的探究:
探究一:铝片与盐酸反应过程中的能量及反应速率的变化。
(1)实验时需将铝片进行打磨,其目的是_____。
(2)反应中试管外壁发烫,说明铝与盐酸反应是_____(填“吸热”或“放热”)反应,化学方程式为_____。
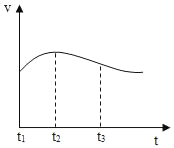
(3)实验测得铝片产生气体的速率(v)与时间(t)的关系如图所示,t1~t2时间内反应逐渐加快的主要原因是_____。
(查阅资料)铁、铜均能与氯化铁溶液反应,化学方程式分别为:2FeC13+Fe═3FeCl2、2FeCl3+Cu=2FeCl2+CuCl2
(4)向氯化铁和氯化铜的混合溶液中,加入一定量的铁粉,充分反应后过滤。取少量滤渣加入稀盐酸,有气泡产生。则滤液中的溶质是_____,滤渣中一定含有_____。
【答案】除去表面的氧化膜等杂质 放热 2Al+6HCl═2AlCl3+3H2↑ 反应放热,溶液温度升高使反应速率加快 FeCl2 Fe、Cu
【解析】
(1)铝的化学性质较活泼易形成氧化铝保护膜,打磨后有利于反应的进行,故答案为:除去表面的氧化膜等杂质;
(2)反应中试管外壁发烫,说明铝与稀盐酸反应是放热反应,铝与盐酸反应会生成氢气及氯化铝,反应的化学方程式为:2Al+6HCl═2AlCl3+3H2↑,故答案为:放热 2Al+6HCl═2AlCl3+3H2↑;
(3)金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快,故答案为:反应放热,溶液温度升高使反应速率加快;
(4)取少量滤渣加入稀盐酸,有气泡产生,说明滤渣中有铁,溶液中只有氯化亚铁,故答案为:FeCl2; Fe、Cu。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目