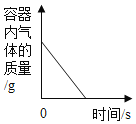
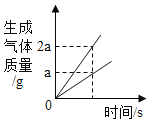
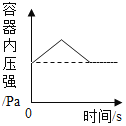
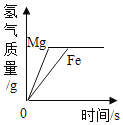
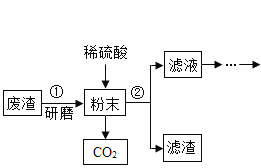
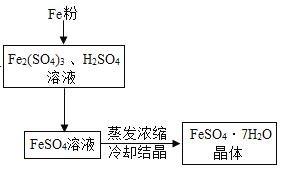
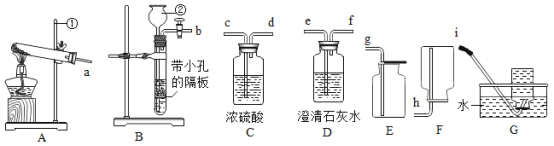
题目内容
【题目】小昆同学要配制80g溶质的质量分数为20%的氯化钠溶液其配制过程如图所示。请回答下列问题:

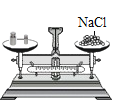
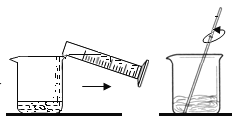
(1)小昆同学需要称量氯化钠的质量和水的体积分别为_____、_____(水的密度为1g/cm3),图示实验中玻璃棒的作用是_____。
(2)图示实验中有一处明显的错误是_____,这种错误操作会使配制的溶液溶质的质量分数_____(填“偏大”或“偏小”或“不变”)。
【答案】16g 64mL 搅拌,加速溶解 使用天平没有左侧放置物品,右侧放置砝码 偏小
【解析】
溶质质量=溶液质量×溶质的质量分数;溶剂质量=溶液质量-溶质质量。
(1)要配制80g质量分数为20%的氯化钠溶液,应称取氯化钠的质量为:80g×20%=16g,需要量取水的质量:80g-16g=64g;水的体积为:![]() =64mL;图示溶解实验中玻璃棒的作用是搅拌,加速溶解。故填:16g;64mL;搅拌,加速溶解;
=64mL;图示溶解实验中玻璃棒的作用是搅拌,加速溶解。故填:16g;64mL;搅拌,加速溶解;
(2)天平称量遵循左物右码的原则,左侧放置物品,右侧放置砝码;天平称量物体的原理是:左盘质量=右盘质量+游码质量,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,并且在称量过程中使用了游码,则会使称取的质量小于所需的质量,会使配制的溶液溶质的质量分数偏小。故填:使用天平没有左侧放置物品,右侧放置砝码;偏小。

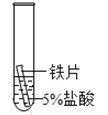
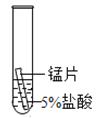
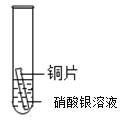
【题目】某研究小组为探究铁、铜、锰(Mn)、银的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用溶液的体积相同)。下列判断不正确的是
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 立即产生气泡,速率较快 | 铜片的表面有银白色固体,一段时间后。溶液由无色变为蓝色 |
A.通过实验一和实验二的反 应剧烈程度,能判断出铁和锰的金属活动性强弱
B.在上述三个实验基础上再增加一个铜和5%盐酸的实验,则能判断出四种金属的活动性顺序
C.通过上述三个实验,能判断出四种金属的活动性顺序
D.通过实验三的反应现象,能判断出铜和银的金属活动性强弱
【题目】在学习金属的化学性质时,老师在课堂上给学生们演示了如图实验:
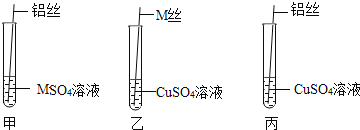
(给出资料)M是一种金属,![]() 溶液是无色液体。
溶液是无色液体。
(实验目的)探究M与铜、铝的活动性顺序。
(猜想与假设)
猜想Ⅰ:![]() ;
;
猜想Ⅱ:![]() ;
;
猜想Ⅲ:_____。
(进行实验)
第一步:老师取出M丝、铜丝、铝丝用砂纸进行打磨,目的是_____。
第二步:老师按照如图进行实验操作,要求同学们填写如下表格:
实验操作 | 实验想象 | 实验结论 |
铝丝插入装有 | 铝丝表面出现一层黑色物质 | _____ |
M丝插入装有 | M丝表面出现一层红色物质,溶液的颜色_____。 | M>Cu |
铝丝插入装有 | M丝表面出现一层红色物质,颜色由蓝色变为无色 | Al>Cu |
第三步:根据表格,可判断猜想_____正确。
(交流表达)
老师要求同学们写出试管丙中反应的化学方程式_____。然后经同学们讨论后大家认为该实验可以优化,去掉试管_____![]() 填试管编号
填试管编号![]() 中的实验,也可以得出正确的结论。
中的实验,也可以得出正确的结论。
(评价与反思)
实验结束后,同学对实验过程进行了如下反思:如果M能够和稀酸溶液反应,探究金属![]() 铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断
铜、铝活动性顺序时,除了上述实验中已经用到的方法外,还可以根据_____进行判断![]() 任写一种
任写一种![]() 。
。