题目内容
【题目】现有l00g 8%的NaOH溶液,通过计算回答下列有关问题:
(1)若用该溶液吸收CO2,最多可以生成Na2CO3多少克?____(写出详细计算过程)
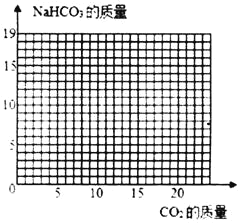
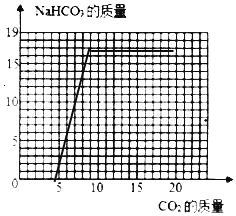
(2)当NaOH全部转化成为Na2CO3后,Na2CO3还会继续与CO2、H2O发生反应:Na2CO3+CO2+H2O=2NaHCO3,直至Na2CO3完全反应完。请在如图画出利用l00g8%的NaOH溶液吸收CO2与生成NaHCO3的曲线。____
(3)现有三种溶液:①100g8%NaOH溶液、②100g8%NaOH溶液吸收CO2转化为Na2CO3溶液、③100g8%NaOH溶液吸收过量CO2转化为NaHCO3溶液,分别用相同质量分数的硫酸与上述三种溶液恰好完全反应,需要的硫酸的质量_____(选填“相等”或“不相等”),原因是_____。
【答案】10.6g 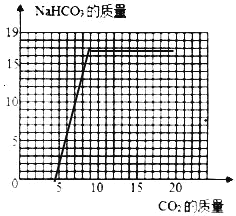 相等 三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等
相等 三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等
【解析】
(1)100g8%的NaOH溶液中含NaOH的质量=100g×8%=8g
(2)设碳酸钠的质量为x,与氢氧化钠反应的二氧化碳的质量为y,碳酸氢钠的质量为z,和碳酸钠反应的二氧化碳的质量为a
根据2NaOH+CO2=Na2CO3+H2O和 Na2CO3+CO2+H2O=2NaHCO3,可得关系式为:
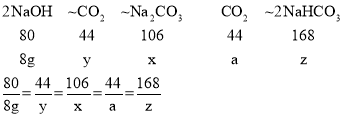
x=10.6g
y=4.4g
z=16.8g
a=4.4g
利用l00g8%的NaOH溶液吸收CO2与生成NaHCO3的曲线,起点4.4、拐点(8.8,16.8)。如图:
(3)三种溶液中所含的钠元素质量相等,根据钠元素守恒和硫元素守恒,可知与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。
故答案为
(1)10.6g;(2)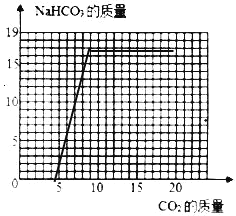 ;(3)相等; 三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。。
;(3)相等; 三种溶液中所含的钠元素质量相等,与硫酸反应产生的Na2SO4质量相等,故消耗同种硫酸的质量相等。。

【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.
(提出问题)锌与硫酸反应的快慢受哪些因素的影响呢?
(猜想与假设)a可能与硫酸的质量分数有关;b可能与锌的形状有关.
(设计并实验)小兵用不同质量分数的硫酸和不同形状的锌进行如下实验.
实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
① | 30% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 20% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式______.
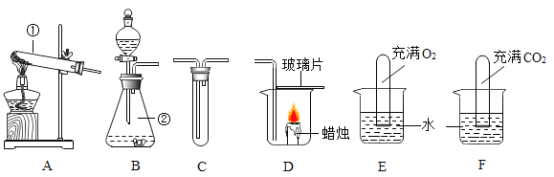
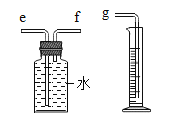
(2)小兵用如图装置收集并测量氢气的体积,其中量筒的作用是______,氢气应从______(填e或f或g)管通入.
(3)若用该收集CO2,并测量生成的CO2气体的体积,其中在水面上放一层植物油目的是______;
(收集证据)(4)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是______.
(得出结论)(5)结论是______
(评价与反思)(6)下表是小兵第①组实验的详细数据.
时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因______.
(7)锌与硫酸反应的快慢可能还受哪些因素影响?_____设计实验验证.______.
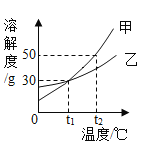
【题目】根据物质的溶解度表和物质的溶解度曲线,回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
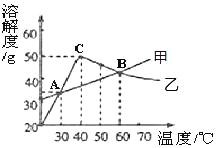
(1)向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量_____(填“增大”“不变”或“减小”)。
(2)混有少量氯化钠的硝酸钾固体,加水配成80℃的硝酸钾饱和溶液,再冷却至20℃,析出晶体并得到溶液。下列有关说法中正确的是_____(填字母)。
A 析出的晶体中不一定含有硝酸钾
B 所得溶液一定是硝酸钾饱和溶液
C 上述方法可以将两种物质完全分离
(3)将甲、乙饱和溶液从60℃降温到40℃,溶质的质量分数是:甲_____乙(填“>”、“=”、“<”)。
(4)等质量的甲、乙饱和溶液从30℃升温到60℃,为使其溶液恰好饱和,加入的甲、乙固体质量_____(填“相等”或“不相等”)。
【题目】下表是几种原子或分子的示意图,根据图示的反应历程判断,下列说法错误的是( )
图例 |
|
|
|
|
|
|
|
|
原子或分子 | 1个A原子 | 1个B原子 | 1个C原子 | 1个D原子 | 1个AD2分子 | 1个B2分子 | 1个BD2分子 | 1个CB分子 |
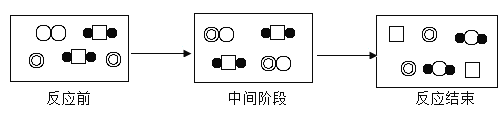
A.该反应是置换反应B.反应中间阶段发生了化合反应
C.反应结束阶段发生了复分解反应D.物质C是反应的催化剂
【题目】某化学兴趣小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动:
[查阅资料]铁的活动性比铜强。
[进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一: R>Fe>Cu;
猜想二:_____
猜想三: Fe>Cu>R
[收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | |
甲 | 将打磨好的R丝插入盛有硫酸铜溶液的试管中 | _____ | 猜想一正确 |
乙 | 将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R 丝表面产生气泡速率比铁丝表面产生气泡速率_____(填“快”或“慢”) | |
丙 | 将粗细相同打磨好的R丝、铁丝,分别在空气中点燃 | R 丝在空气中剧烈燃烧,铁丝在空气中不燃烧 |
写出铁丝与稀盐酸反应的化学方程式_____。
[交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与_____是否反应。