题目内容
【题目】已知金属锰(Mn) 的活动性位于铝和锌之间,请预测硫酸锰(MnSO4)的化学性质,说明预测的依据,并设计实验验证。经查阅资料,锰的化合物相关性质如下:
物质 | MnO | Mn(OH)2 | MnCl2 | Mn(NO3)2 | MnSO4 | MnCO3 |
在水中的溶解性 | 不溶于水的草绿色粉末 | 难溶于水的白色固体 | 可溶于水形成淡红色溶液 | 溶于水形成淡红色溶液 | 溶于水形成淡红色溶液 | 难溶于水的粉红色固体 |
限选试剂:MnSO4溶液、(NH4)2CO3溶液、Na2SO4溶液、BaCl2溶液、NaOH溶液、稀盐酸、镁条、铜片。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 | ||||||
①能够与含Ba2+的可溶性盐反应 | MnSO4溶液中含 | 取少量MnSO4溶液于试管中,_____,如果观察到_____,则预测成立。 | ||||||
②能够与_____(填物质类别)反应 | _____。 | 取少量MnSO4溶液于试管中,_____,如果观察到_____,则预测成立。 | ||||||
③能够与_____(填物质类别)反应 | _____。 | 取少量MnSO4溶液于试管中,_____,如果观察到_____,则预测成立。 |
第一周期 | 1 H 1.008 | 2 He 4.003 | ||||||
第二周期 | 3 Li 6.941 | 4 Be 9.012 | ① | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.81 |
第三周期 | ② | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | ③ | 18 Ar 39.95 |
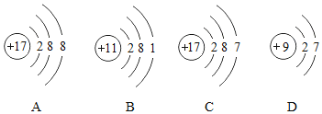
(1)学习化学后,我们学会了从微观角度认识事物.根据如上图四种粒子的结构示意图,回答问题:
①它们属于同种元素的是_____(填序号,下同)
②图C是某元素的原子结构示意图,该元素在元素周期表中的位置是_____(选填①或②或③)
(2)原子序数为12的元素的原子在化学反应中易_____(填“得”或“失”)电子,形成离子的符号是_____。该元素在化合物中的化合价为_____价,该元素和原子序数为9的元素组成的化合物是_____(填化学式)。
(3)探究金属钠与水反应时,发现有气体生成,收集气体并点燃,有明显爆鸣声,向反应后溶液中滴加酚酞试剂,溶液呈红色,由此推断,钠与水反应的化学方程式为_________,反应基本类型是_________。