题目内容
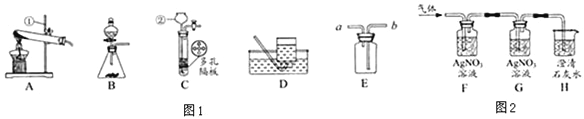
【题目】下图所示为实验室常见气体制备、净化、干燥、收集和性质实验的部分仪器。(组装实验仪器时,可重复选择仪器),某校化学小组欲用它们完成各自的探究实验。
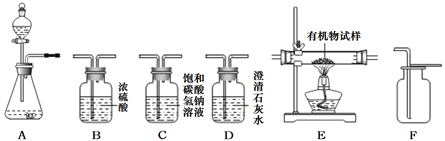
(1)第一组同学以石灰石和稀盐酸为原料,在实验室中制备并收集一瓶干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。
(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液去除)
①所选仪器的连接接顺序为__________(写仪器序号字母)。
②制取二氧化碳所发生反应的化学方程式为______________________。
③若将制得的二氧化碳通入足量的饱和澄清石灰水中,恰好完全反应时,所得溶液的质量将比之前溶液的质量__________(“变大”,“受"“不之一)。其原因是_______________。
④下列关于二氧化碳制取和性质的叙述中,不正确的是_________(填序号之一)。
A.二氧化碳碳能溶于水且与水反应,所以通常不采用排水法来收集
B.二氧化碳既不能燃烧,也不支持燃烧,所以可用于灭火
C.二氧化碳的水溶液能使紫色石蕊试液变红,所以二氧化碳是酸
D.通过分液漏斗可以控制稀盐酸的滴入量,从而控制反应速率
(2)第二组同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某有机物的组成元素进行分析探究(已知有机物只含C、H两种元素),所选仪器按A→B1→E→B2→D→碱石灰干燥管的顺序连接,(B1、B2为浓硫酸洗气瓶),实验前检验装置气密性。使该有机物在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应)。试回答下列问题:
①装置A中发生反应的化学方程式为:____________________________。
②装置E中的玻璃管内放入一定质量的有机物试样,将其充分燃烧后,测得装置B2质量增加ag,则该有机物样品中,氢元素的质量为___________(计算结果用含字母的代数式表示)。
③上述实验中,装置B1的作用是____________________。若没有连接装置B1(其他仪器连接顺序不变),这样测算出的有机物中氢元素的质量分数与实际值比较将_____________(填“偏大”、“偏小”、“基本一致”之一)。
【答案】 A→C→B→F CaCO3+2HCl=CaCl2+H2O+CO2↑ 变小 生成沉淀的质量大于吸收二氧化碳的质量 C 2H2O2![]() 2H2O+O2↑
2H2O+O2↑ ![]() 干燥氧气,排除水分的干扰 偏大
干燥氧气,排除水分的干扰 偏大
【解析】(1)①实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气大,所以所选仪器的连接顺序为ACBF;②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;③二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3 ↓+H2O;由于生成沉淀的质量大于吸收二氧化碳的质量,所得溶液的质量将比之前溶液的质量变小;④A、二氧化碳碳能溶于水且与水反应,所以通常不采用排水法来收集,正确;B、二氧化碳既不能燃烧,也不支持燃烧,所以可用于灭火,正确;C、二氧化碳的水溶液能使紫色石蕊试液变红,是因为二氧化碳和水生成碳酸,错误;D、通过分液漏斗可以控制稀盐酸的滴入量,从而控制反应速率正确;(2)①过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;②浓硫酸具有吸水性,仪器B2质量增加ag就是水的质量,该塑料试样中H元素的质量分数为:a×
2H2O+O2↑;②浓硫酸具有吸水性,仪器B2质量增加ag就是水的质量,该塑料试样中H元素的质量分数为:a×![]() =
=![]() g;B1为浓硫酸,是吸收氧气中水分,排除水分的干扰;仪器B1是吸收过氧化氢分解生成的水,没有连接仪器B1时,仪器B2吸收的水的质量会偏大,测算出的该塑料试样中H元素的质量与实际值比较将偏大。
g;B1为浓硫酸,是吸收氧气中水分,排除水分的干扰;仪器B1是吸收过氧化氢分解生成的水,没有连接仪器B1时,仪器B2吸收的水的质量会偏大,测算出的该塑料试样中H元素的质量与实际值比较将偏大。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案