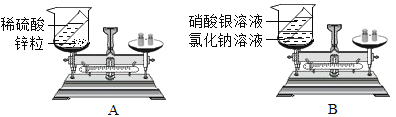
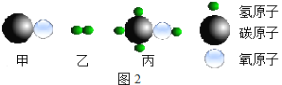
题目内容
【题目】某工厂产生的烧渣(主要含FeO、Fe2O3,还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4·7H2O),其工艺流程如下:
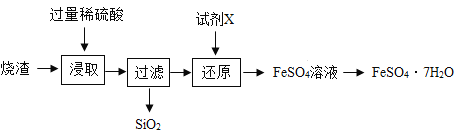
查阅资料:SiO2不溶于水,也不与稀硫酸反应。
(1)为提高“浸取”步骤的反应速率,可采取的具体措施有______________ (写1条即可)。
(2)“还原”步骤的目的是将Fe转化为Fe2+,试剂X可用SO2或Fe。
①若试剂X是SO2,转化原理为SO2+Fe2(SO4)3+2Y =2FeSO4+2H2SO4,则Y的化学式是_________ 。
②若试剂X是Fe,转化原理为Fe+Fe2(SO4)3=3FeSO4。用此法测得“还原”后溶液的pH明显增大,其原因是____________________ 。
【答案】搅拌或振荡、使用催化剂、增大硫酸的浓度、升高温度、将烧渣粉碎等 H2O 铁消耗过量的稀硫酸,溶液酸性减弱
【解析】
(1)为提高“浸取”步骤的反应速率,可采取的具体措施有:搅拌或振荡、使用催化剂、增大硫酸的浓度、升高温度、将烧渣粉碎等;
(2)①由反应的化学方程式可知,反应前后硫原子都是4个,铁原子都是2个,反应后氧原子是16个,反应前应该是16个,其中2个包含在2Y中,反应后氢原子是4个,反应前应该是4个,都包含在2Y中,所以Y是H2O;
②若试剂X是Fe,转化原理为Fe+Fe2(SO4)3=3FeSO4.测得“还原”后溶液的pH明显增大,其原因是铁消耗过量的硫酸,溶液酸性减弱。
故答案为:(1)搅拌或振荡、使用催化剂、增大硫酸的浓度、升高温度、将烧渣粉碎等;
(2)①H2O;②铁消耗过量的稀硫酸,溶液酸性减弱。

【题目】某兴趣小组通过实验探究人体吸入的空气与呼出的气体成分。
学习资料:
(1)二氧化碳可以使澄清石灰水变成白色浑浊液,白色浑浊物越多,说明气体中二氧化碳越多
(2)氧气可以使带火星木条复燃,木条燃烧越旺,说明氧气越充足
(3)二氧化碳可以使燃着的木条熄灭
实验探究:
实验一:取两个空集气瓶,用玻璃片将瓶口盖好,收集两瓶空气样品
实验二:用排水法收集满两瓶人体呼出的气体,用玻璃片盖好瓶口
实验三:将燃着的木条分别插入空气样品和呼出气体样品的集气瓶中,观察现象并记录下表:
空气样品 | 呼出气体样品 | |
现象 | ____________ | ____________ |
结论 | ____________ | |
写出木条燃烧的文字表达式___________________。
实验四:向另一瓶空气样品和呼出气体的样品中滴加相同滴数的澄清石灰水,振荡,观察现象并完成下表:
空气样品 | 呼出气体样品 | |
现象 | ____________ | ____________ |
结论 | _____________________ | |
实验五:取两块干燥的玻璃片,对着其中一块哈气,对比观察两块玻璃片观察到现象是________________________。
实验总结:通过实验,比较人体吸入的空气和呼出的气体中含二氧化碳、氧气水蒸气的多少?得出的结论是___________________。