题目内容
【题目】日常生活中常用氢氧化钠溶液来清洗炉具、油烟机等,李华在周末帮助家人清洗油烟机,他用自来水配制氢氧化钠溶液时总是出现浑浊,静置一会儿溶液底部还会出现较多的白色沉淀物。
(提出问题)配制氢氧化钠溶液时为什么会出现浑浊?
(作出猜想)李华根据课本知识对出现的异常现象作出如下猜想:
猜想Ⅰ:所用氢氧化钠不纯,其中含有不溶性杂质。
猜想Ⅱ:氢氧化钠能与自来水中的某种物质反应,生成了难溶性物质。
(查阅资料)①徐州地区石灰岩分布广泛,导致水中含有较多的碳酸氢钙[Ca(HCO3)2]。
②在溶液中,碳酸氢钙能与氢氧化钠反应生成碳酸钙。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳和水。
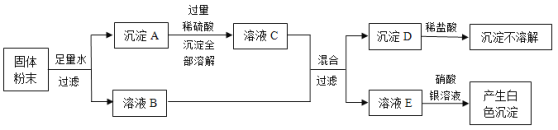
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①取氢氧化钠样品少许,加入足量的_______,并搅拌 | 没有出现浑浊 | 猜想I错误 |
②取少许配制氢氧化钠溶液时产生的白色沉淀物,加入足量的稀盐酸 | __________ | 白色沉淀物是_________,猜想Ⅱ正确 |
(拓展延伸)
(1)李华在家里将该自来水经过________后可用于配制氢氧化钠溶液,其原理是_____________(用化学方程式表示)。
(2)李华设计如图W形玻璃管进行步骤②探究稀盐酸的浓度对反应速率的影响(反应时只要将W形玻璃管竖起即可将药品混合),通过对比________可判断反应的快慢,该装置的优点是________。
【答案】蒸馏水 固体溶解,有气泡产生 碳酸钙(或CaCO3) 煮沸 ![]() 气球鼓起的速度 装置简单,便于添加药品,实验现象明显
气球鼓起的速度 装置简单,便于添加药品,实验现象明显
【解析】
实验验证:
①如果将氢氧化钠样品加入足量的蒸馏水中,充分搅拌后全部溶解,则说明该氢氧化钠样品中没有不溶性杂质,即猜想I错误。
②根据实验结论“猜想Ⅱ正确”可知,该白色沉淀物是水中的碳酸氢钙与氢氧化钠反应生成碳酸钙,因此加入稀盐酸后的实验现象是固体溶解,有气泡产生。
拓展延伸:
(1)该地自来水中含有碳酸氢钙,碳酸氢钙受热易分解,因此经过煮沸后,水的硬度降低,用此水配制氢氧化钠溶液就不会出现不溶物。煮沸时,碳酸氢钙分解生成碳酸钙、水和二氧化碳,有关的化学方程式是![]() 。
。
(2)通过对比气球鼓起的速度可判断反应的快慢,该装置的优点是装置简单,便于添加药品,实验现象明显。

【题目】实验室通常利用如图装置制取氧气。

写出KClO3在MnO2作用下制取氧气的化学方程式______;
某化学兴趣小组在实验过程中发现有以下“异常”现象:
a.利用排空法收集氧气有异味;
b.颗粒状MnO2变得更细。
对此进行了以下探究:
探究(I)利用排空法收集的氧气有异味
查阅资料:KClO3在MnO2作用下分解生成氧气,经历了以下三个过程
①2KClO3+2MnO2![]() 2______+Cl2↑+O2↑
2______+Cl2↑+O2↑
②2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
③Cl2+K2MnO4![]() 2KCl+MnO2+O2↑;
2KCl+MnO2+O2↑;
(1)写出横线物质的名称______,其中Mn元素的化合价为______;
(2)猜测“利用排空法收集氧气有异味”的物质是______。
探究(Ⅱ)颗粒状MnO2变得更细
学习小组通过讨论猜测:是因为MnO2也参加了化学反应。小组同学共同设计实验并验证MnO2在该反应中作催化剂。
实验操作 | 实验现象 | 解释 | |
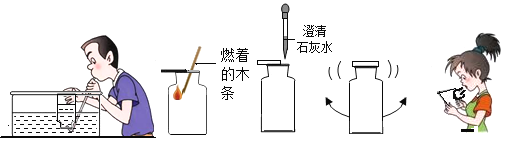
实验一 | 将KClO3加热至融化,伸入带火星的木条。 | 木条一段时间后复燃 | KClO3受热要分解产生氧气; |
实验二 | 加热MnO2,伸入带火星的木条 | ______ | MnO2受热不产生氧气; |
实验三 | 取适KClO3和2g的 ______ | 木条迅速复燃 | MnO2 ______ (填“加快”或“减慢”)KClO3的分解 |
实验结论:MnO2是KClO3受热分解的催化剂。
归纳反思:该小组的实验结论受到其他小组的质疑,为此该小组又补充以下实验:
(1)待试管完全冷却后,向实验三的试管中加蒸馏水,将混合物全部转移至烧杯,过滤(MnO2不溶于水,其他物质均能溶于水),洗涤沉淀,烘干,称量,目的是验证______;称量所得固体质量______;
(2)设计实验验证催化剂的另一个特点,实验方案______。