题目内容
【题目】某化学兴趣小组的同学在做氢氧化钙与盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
Ⅰ.定性探究
【提出问题】该溶液中的溶质含有哪些成分?
【查阅资料】CaCl2溶液呈中性。
【猜想与假设】
猜想Ⅰ:溶液中的溶质只有____________;
猜想Ⅱ:溶液中的溶质有CaCl2、HCl;
猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2;
猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl。
(1)经过讨论,同学们直接得出不合理的猜想是哪一种并说出理由:___________________。
为了验证余下的哪一种猜想是正确的,同学们又做了以下实验。
【进行实验】研究
(2)
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | 溶液不变色 | 猜想Ⅲ不正确 |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想_______正确 |
(3)操作②有气泡生成的化学方程式为_________________________。
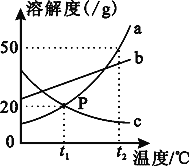
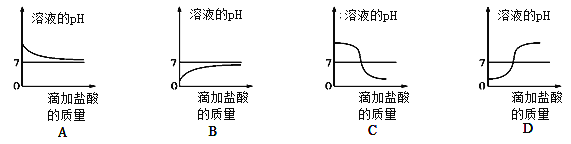
(4)下列曲线能够表示所做实验中溶液pH变化趋势的是________(填序号)。
【反思交流】
(5)要使烧杯内溶液的溶质只含CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的_______________,然后过滤。
Ⅱ.定量探究
(6)兴趣小组同学想对本地化工厂排放废水中的HCl含量进行了测定(不含其他酸性物质)。取废水5 g,用质量分数为2%的氢氧化钙溶液进行中和,如下图所示。请你计算废水中HCl的质量分数。(写出具体的计算过程)___________

【答案】 CaCl2 猜想Ⅳ,盐酸和氢氧化钙相互反应。不能共存 猜想Ⅱ正确 Na2CO3+2HCl=2NaCl+H2O+CO2↑ C 碳酸钙/石灰石/大理石 14.6%
【解析】【猜想与假设】反应可能是一种物质完全反应,另一种物质有剩余:若氢氧化钙过量,则含有氢氧化钙和氯化钙;若盐酸过量,则含有盐酸和氯化钙;也可能是恰好反应:只有氯化钙;故填:CaCl2;
(1)因为稀盐酸与氢氧化钙在溶液中不能共存,所以猜想四不合理;
(2)再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠,有气泡产生,则证明剩余溶液中含有HCl,则猜想Ⅱ成立,猜想Ⅰ不成立;
(3)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)氢氧化钙溶液显碱性,pH>7,逐渐加入盐酸,随着反应进行,碱性逐渐减弱至中性,后盐酸过量,pH<7,故选:C;
(5)要使烧杯内溶液的溶质只含CaCl2,需要除去杂质,即除去稀盐酸,可加入过量的碳酸钙(或石灰石或大理石),碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,然后过滤;
(6)设废水中HCl的质量为x,
37g氢氧化钙溶液中含溶质Ca(OH)2的质量为37g×2%=0.74g
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
0.74g x
![]()
x=0.73g
废水中HCl的质量分数为![]() ×100%=14.6%
×100%=14.6%
答:废水中HCl的质量分数为14.6%。

【题目】化学小组对热水壶底部水垢的主要成分进行了如下探究,请回答问题。
【查阅资料】天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表。

【提出猜想】水垢的主要成分中一定含有______和_________(填化学式),可能含有Ca(OH)2和MgCO3。
【设计方案】 实验1:确定水垢中是否含Ca(OH)2和CaCO3
实验步骤 | 实验现象 | 结论 |
在少量研碎的水垢中加入适量的蒸馏水充分搅拌,过滤,在滤液中加入Na2CO3溶液。 | 没有白色沉淀产生 | 一定不含 Ca(OH)2 ,一定含 CaCO3 |
实验2:确定水垢中是否含MgCO3
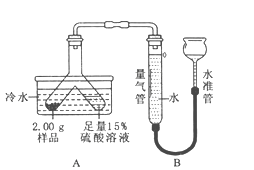
利用下列实验装置,完成实验2探究。其主要实验步骤如下:
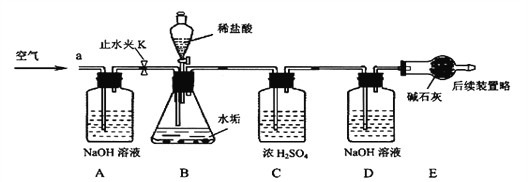
称量D、E装置总质量为600.00g,按上图组装后,将2.50g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为601.25g(碱石灰主要成分为CaO和NaOH,不考虑装置内空气对实验的影响)。
【实验讨论】(1)加入样品前应_______________________________。
(2)反应结束后打开止水夹K,缓缓鼓入空气的目的是_______________________,装置A的作用是________________________________ 。
(3)A、B装置之间_____设置干燥装置(填:“要”或“不要”),理由是_____________。
(4)装置B中生成CO2的质量为______g。通过计算说明水垢中_____含MgCO3(填字母)。
A. 一定 B. 一定不 C. 可能 D. 无法确定
实验3:确定水垢中是否含有Mg(OH)2
(5)另取质量为2.50g的水垢,加入3.65%的稀盐酸与之反应,测得消耗稀盐酸w g。结合以上实验结论,判断w的值满足________________条件时,水垢中一定含有Mg(OH)2。