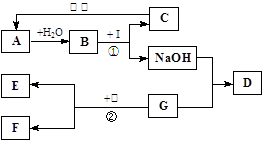
题目内容
(8分)某粗盐样品中含有杂质氯化镁、氯化钙.某同学设计了以下提纯方案:
请回答下列问题:
(1)方案中加入过量试剂a若为氢氧化钠溶液,则其目的是为了除去粗盐中的 。
(2)在过滤操作中,除用到带铁圈的铁架台、烧杯、玻璃棒外,还需要用到的仪器是 。
(3)滤液B中所含的溶质为 。
(4)向滤液B滴加稀盐酸的过程中,当观察到的溶液的现象为 时,应停止滴加,如果滴加的稀盐酸过量,对最后得到的精盐晶体的成分 (填“有”或“没有”)影响。
(5)操作C的名称为 。
(6)工业上用电解饱和食盐水的方法可制取氢氧化钠、氢气、和氯气,写出反应的化学方程式 。
(1)氯化镁;(2)漏斗;(3)氯化钠、氢氧化钠,碳酸钠;(4)无气泡放出;没有;(5)蒸发;(6)2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
解析试题分析:(1)因为钠盐都溶于水,而氢氧根离子会将镁离子转化为氢氧化镁沉淀,生成氯化钠;(2)过滤实验中要用到的仪器有:漏斗、铁架台、烧杯、玻璃棒;(3)前面的除杂各步后都生成氯化钠,但是在除杂时加入的氢氧化钠和碳酸钠(除去氯化钙时,用过量的碳酸钠,即过量的试剂b)都是过量的;(4)向滤液B滴加稀盐酸的过程中,当观察到溶液中不产生气泡时,说明恰好完全反应,停止滴加;过量的稀盐酸对最后得到的精盐晶体的成分没有影响,因为稀盐酸不与氯化钠反应;(5)得到精盐晶体之前的操作是蒸发;(6)由分析可知,反应物、生成物、反应条件;故可书写此化学方程式为:2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
考点:氯化钠与粗盐提纯;过滤的原理、方法及其应用;酸的化学性质;盐的化学性质;书写化学方程式

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(4分)甲、X、Y是初中化学中的常见物质,请根据下列叙述回答问题。
(1)若甲既可以作气体燃料,又可以用作还原剂冶炼金属铁。则甲的化学式是 ;用其还原氧化铁的化学反应方程式是 。
(2)若甲可以由Y与水在常温下反应制得,且可用来改良酸性土壤,则下列叙述正确的是 。(填字母序号)。
| A.Y与水的反应属于化合反应 |
| B.甲易吸收空气中的水分而变质,所以需密封保存 |
| C.向滴有酚酞试液的甲的溶液中加入一定量的稀盐酸,溶液最终为无色,则所得溶液中的溶质只有CaCl2 |
| D.将少量Y加到甲的饱和溶液中,溶液变浑浊,反应后溶液中溶质和溶剂的质量一定减小,溶质的质量分数可能不变 |
(9分)我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
【资料】四种盐在不同温度下的溶解度表
| | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | —— | —— |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | —— |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
⑵操作a是 ,生产流程中被循环利用的物质是 ;
⑶在精盐水中先通入NH3,使溶液呈 性,再通入CO2,有利于对CO2的吸收;
⑷氨盐水中通入二氧化碳后,在常温条件下,易析出NaHCO3晶体而不析出NH4Cl晶体的可能原因是 ;
⑸粗盐水中主要含有CaCl2、MgCl2等杂质,工业上常加入下列物质除杂、精制,则加入下列三种试剂合理的顺序为 (填序号);
A.适量的盐酸 B.稍过量的Na2CO3溶液 C.稍过量的Ca(OH)2溶液
⑹副产品NH4Cl可做 肥,若加入氢氧化钠加热,反应的化学方程式为 。
下列化学实验能够成功的是
| A.小明用木炭代替红磷做测定空气中氧气含量的实验 |
| B.小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性 |
| C.小聪在20℃配制36%的氯化钠溶液(20℃时氯化钠的溶解度为36 g) |
| D.小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜 |